
����Ŀ�����ӽ���Ĥȼ�ϵ��(��ƣ�PEMFC)���ֳƹ���߷��ӵ����ȼ�ϵ�أ���һ���Ժ���ȼ����������ò���������������ȼ�ϵ�أ�Ĥ����ͼ���崮����ϳ�һ��ȼ�ϵ�ضѡ�Ŀǰ��������ȼ�ϵ�ر��ܵ�Դ�о�������Ա��עĿ�����Ľṹ���գ������¶ȵ�(ֻ��80��)������Ѹ�٣������ܶȸߣ�����������������ԭ����ͼ������˵����ȷ����( )
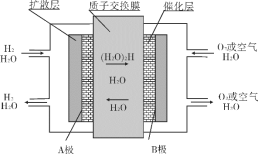
A. ����һ����̼���������ͼ������������(����)�γ����ӽ���Ĥȼ�ϵ�ء�
B. B���ĵ缫��ӦʽΪ��O2+4H++4e-=2H2O
C. �øõ����Ϊ����ͭ�ĵ�Դʱ��A�����ͭ�缫����
D. �����·��ת��0.1moleʱ��ͨ�����ӽ���Ĥ��H+����ĿΪ0.2NA
���𰸡�B
��������
����ͼ֪����ȼ�ϵ���У�����ʧ�������������ӣ�˵���������Һ�����ԣ�ͨ�������ĵ缫A�Ǹ�����������ӦʽΪ2H2-4e-=4H+��ͨ�������ĵ缫B�������������缫��ӦʽΪO2+4H++4e-=2H2O�����ӴӸ����ص����������������ӽ���Ĥֻ��������ͨ�����ݴ˷������
A.����һ����̼���������ͼ������������(����)������ֻ�л�ԭ����ȼ�ϣ�û������������ȼ�������ʲ����γ�ȼ�ϵ�أ�A����
B.ԭ������������������ƶ���B�缫�缫��ӦΪ��O2+4H++4e-=2H2O��B��ȷ��
C.�øõ����Ϊ����ͭ�ĵ�Դʱ����ͭ���������Դ����������AΪ������C����
D.���ڵ�������������������������ͬ�������෴�����Ե����·ת��0.1mol����ʱ��ͨ�����ӽ���Ĥ����������Ŀ0.1NA��D����
�ʺ���ѡ����B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������������й㷺��Ӧ�á�
(1)��ʡ��ؿ�չ�������д����������������������һ����Ҫ�ٴ롣ij�нֵ�����Ͱ��ͼ��ʾ����ش��������⣺

��ͼ�б�ʶ�����ʣ����ڽ������ϵ���__________(д��һ�ּ���)��
��ʹ�����Ͻ�����Ͳ���ŵ���____ (д��һ�㼴��)��ijƷ�����ϵĿ�������Ӧ����_____(�����ɻ������������ɻ�����)Ͳ�С�
������Ʒ��ʴ�Ĺ��̣�ʵ���������������е�________������ѧ��Ӧ�Ĺ��̣���ȥ����Ʒ������������ϡ���ᣬ��Ӧ�Ļ�ѧ����ʽΪ________________________________
(2)���ס��ҡ������ֽ����ֱ�Ͷ��ϡ�����У��ס������������ݲ������������������������������������Һ�У�һ��ʱ��ı����б��������ɴ��ƶ������ֽ����Ļ����ǿ������˳����________________��
(3)��һ�����������ۼӵ�Al(NO3)3��Cu(NO3)2��AgNO3�������ʵĻ����Һ�У���ַ�Ӧ����ˣ��õ���Һ������������˵����ȷ����________ (����ĸ)��
A.����ҺΪ��ɫ����������һ��������������ͭ
B.����Һ�к�������ͭ����������Һ��һ������Al3����Fe3����NO3��
C.����ҺΪdz��ɫ����������һ��������ͭ����
D.�������м�ϡ���������ݲ���������Һ��һ����Al3����Fe2����Cu2����������Ag��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ��������������Na2SO4��ˮ��ԭ����ͼ��ʾ�����ö��Ե缫��ab��cd��Ϊ���ӽ���Ĥ����ֱ���糡�������£���Ĥ�м��Na+��SO42����ͨ�����ӽ���Ĥ�������˸��������ӱ��赲���ܽ����м���ҡ�

����������ȷ���ǣ� ��
A. ͨ����м���ҵ�SO42������������Ǩ�ƣ���������ҺpH����
B. �÷��ڴ�����Na2SO4��ˮʱ���Եõ�NaOH��H2SO4��Ʒ
C. ������ӦΪ2H2O 4e�C = O2+4H+����������ҺpH����
D. ����·��ͨ��1mol���ӵĵ���ʱ������0.5mol��O2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeBr2��һ�ֻ���ɫ���壬ijѧϰС���Ʊ���̽�����Ļ�ԭ��
��.ʵ�����Ʊ�FeBr2
ʵ��������ͼ��ʾװ����ȡ�廯����������AΪCO2����װ�ã�D��d�о�ʢ��Һ�壬EΪ����¯˿�IJ���ֹܣ�e���������µĴ�������ʢ��ϸ���ۡ�
ʵ�鿪ʼʱ�Ƚ����ۼ�����600�桫700�棬Ȼ���������CO2����ͨ��D�У�E���з�Ӧ��ʼ�����Ͻ�d��Һ�����100�桫120���D�У�������Сʱ��������Ӧ�������ܵ�һ�˳����л���ɫ��Ƭ״�廯������
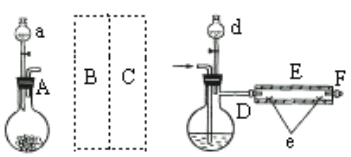
��ش�
(1)����A��ʢ����CaCO3��a��ʢ6mol/L���ᣬB����װ�б���NaHCO3��Һ��ϴ��ƿΪʹ����D�е�CO2Ϊ���﴿�������壬��ͼ��C����װ�ú����е��Լ�Ӧ�ǣ�________,Ϊ��ֹ��Ⱦ������ʵ��ʱӦ��F������ʢ________��β������װ�á�
(2)��Ӧ������Ҫ����ͨ��CO2������Ҫ��������������������CO2�ѷ�Ӧ���п����Ͼ�������________.
��.̽��FeBr2�Ļ�ԭ��
(1)ʵ����Ҫ90 mL 0.1 mol��L��1FeBr2��Һ������FeBr2��Һ���ձ�����Ͳ����ͷ�ιܡ����������IJ���������________��
(2)ȡ10mL����FeBr2��Һ�������еμ��������Ƶ���ˮ������Һ�ʻ�ɫ��ijͬѧ�Բ�����ɫ��ԭ������˼��裺
����1��Br����Cl2������Br2�ܽ�����Һ�У�
����2��Fe2+��Cl2������Fe3+��
���ʵ��֤������2����ȷ��_______________________________
(3)ʵ��֤������ԭ��Fe2+>Br������һ�����ӷ���ʽ��֤����_____________��
(4)����40mL����FeBr2��Һ��ͨ��3��10��3molCl2����Ӧ�����ӷ���ʽΪ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���Ի�ͭ��(��Ҫ�ɷ�Ϊ CuFeS2��������SiO2������)Ϊԭ���Ʊ�ͭ������ƷCuAlO2��һ�ֹ������£�
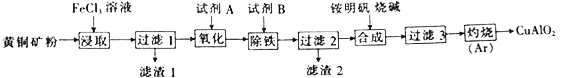
��֪�ٹ���1������Һ�к����������У�Cu2+��Fe2+��Fe3+������1����Ҫ�ɷ���SiO2��S��
��Cu(OH)2+4NH3��H2O=[Cu(NH3)4]2++2OH-+4H2O��
(1)�Ӳ�Ʒ���ȡ�������������ȽǶȿ��ǣ��Լ�A��B����������__________(�����)
a | b | c | d | |
A | HNO3 | NaClO | H2O2 (�ữ) | H2O2 (�ữ) |
B | Cu(OH)2 | NaOH | ��ˮ | Cu(OH)2 CO3 |
(2)������Ļ�ѧʽΪNH4Al(SO4)2��12H2O����Ϊ�Ʊ�ͭ�Ļ�����Ʒ�ṩ��Դ���������Һ��NH4+��A13+��H+��OH-��SO42��Ũ�ȴ�С����Ϊ_______________��
(3)����3�õ�A1(OH)3��Cu(OH)2��д����������������ѧ��Ӧ�ķ���ʽ��_________________��
(4)��λʱ��������ȡ��Cu2+�İٷ���(��Ϊ������)����ҺŨ�ȡ��¶ȹ�ϵ����ͼ��ʾ��
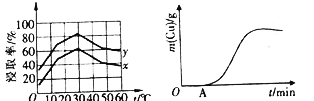
��20��ʱ��1L��Һ����Ч��ײ�ܴ�����x_________y(����>����<������=��)����ͬŨ���£��¶ȸ���30�棬�������������͵���Ҫԭ����_________________��
(5)��ͭ��ʯīΪ�缫�����������1��������Һ�Ʊ�ͭ��ͭ��������ͨ��ʱ���ϵ����ͼ��ʾ��д��OA�������ķ�Ӧ����ʽ��___________________________��
(6)�����£�Ksp[Fe(OH)3]=4.0��10-38�������Լ�B����pH=3ʱc(Fe3+)=_________mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����A��ͨ���������ر�B��ʱ��C���ĺ첼������������������B����C ���ĺ첼������ɫ�������¼�����Һ����Dƿ��ʢ�ŵ���Һ������
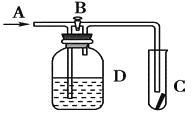
��Ũ���� ��NaOH��Һ ��H2O �������Ȼ�����Һ
A.�٢�B.�٢�C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O(Ħ������376g/mol)��һ���������ռ�������ɫ���壬�ױ����������������ᣬ�����Ҵ���������ˮ�����ѡ����Ʊ�װ��(��ʡ�Լ��ȼ�֧��װ��)�Ͳ�������:
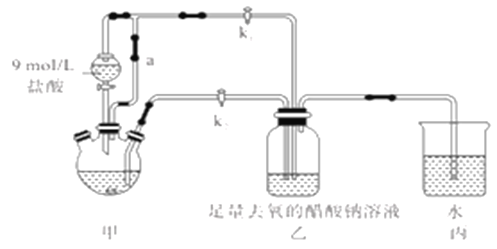
�ټ��װ��������,��������ƿ�����μ������п�ۣ�200mL0.200mol/LCrC13��Һ��
�ڹر�k2��k1,������Һ©�������������ƺõ��١�
�۴�������ƿ�ȵ���Һ������ɫ(Cr3+)��Ϊ����ɫ(Cr2+)ʱ������Һת�Ƶ�װ�����С������ִ�������ɫ����ʱ���رշ�Һ©����������
�ܽ�װ�����л������ٹ��ˡ�ϴ�Ӻ�������õ�11.28g[Cr(CH3COO)2]2��2H2O
��1��װ�ü�����ͨ��a��������________����μ����װ�õ��������Ƿ�����?__________��
��2�����ɺ���ɫ��������ӷ�Ӧ����ʽ____________________________��
��3�����������Һ�Զ�ת����װ�����е�ʵ�����Ϊ________________��
��4��װ�ñ���������________________��
��5��Ϊ�õ���������IJ�Ʒ��ϴ��ʱ��ʹ�õ��Ⱥ�˳��ѡ������ϴ�Ӽ�__________(�����)��
������ ������ˮ(�����ȴ) ����ˮ�Ҵ� ������
��6����ʵ����[Cr(CH3COO)2]2��2H2O�IJ�����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����κ�����ɳ�Լ�Ca2+��Mg2+��SO42�������ʣ����ᴿ����һ�㾭���������̣�

ij��ȤС�鰴�����������д����ᴿʵ�飬ʵ�����ṩ�˴�����Ʒ��ϡ���ᡢNaOH��Һ��BaCl2��Һ��Na2CO3��Һ��ҩƷ�Լ��ر���ʵ���������ɡ���ش��������⣺
��1�������ٴ�����Ʒ��ˮ֮ǰ����Ҫ����������α�ΪϸС�������ĩ����ʱ��ʵ��������Ҫ�õ�������Ϊ__________��
��2�������ڡ��ܹ��˺����Һ���л��ǣ���Ҫ���еIJ�����___________________��
��3�������۰�abc˳�����μ���������Լ�����aΪNaOH��Һ����cΪ________������c������Ӧ�����ӷ���ʽΪ_________________________________________________��
��4�����������ҺpH��Ŀ����________________________________��
��5���������������______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com