
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
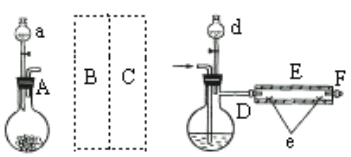
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
【答案】浓H2SO4的洗气瓶 NaOH溶液 将Br2蒸气带入反应管中 100 mL容量瓶 向黄色溶液中加入少量KSCN溶液,若溶液变血红色,则证明假设2正确 Fe2++Br2=2Fe3++2Br- 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
【解析】
I. (1)装置B用于除去CO2中的HCl气体;装置D作用是干燥CO2气体,根据Br2的性质选择合适的尾气处理试剂;
(2)通入CO2,可以将容器中的空气赶净;将Br2蒸气带入反应器D中;
II.(1)根据选择仪器的标准和配制一定体积、一定物质的量浓度的溶液的步骤选择合适的仪器;
(2)Fe2+被Cl2氧化成Fe3+ ,可向该溶液中加入KSCN溶液来检验是否含有Fe3+;
(3)根据还原剂的还原性大于还原产物,只要在含有Fe2+的溶液中滴加溴水即可;
(4) 40mL0.1mol/LFeBr2溶液中溶质的物质的量是0.004mol ,通入3×10-3molC12,二者的物质的量比为4:3反应,结合还原性Fe2+>Br-,由氧化还原反应的先后规律和电子守恒可知:亚铁离子全部被氧化,溴离子只有四分子之一被氧化。
I. ( 1 )装置B用于除去CO2中的HCl杂质气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气;装置D作用是干燥CO2,可以用盛有浓H2SO4的洗气瓶干燥;Br2会导致大气污染,可根据Br2与NaOH溶液作用产生可溶性的物质的性质,用NaOH溶液作尾气吸收试剂。
(2)反应过程中要不断地通入CO2,其主要作用是:①反应前将容器中的空气赶净,避免空气中的氧气干扰实验;②反应过程中要不断通入CO2,还可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应;
II.(1)配制一定体积、一定物质的量浓度的溶液需要的仪器有天平、药匙、烧杯、玻璃棒、一定规格的容量瓶、 胶头滴管,实验室没有90mL容量瓶,根据选择仪器的标准“大而近”的原则,要使用100mL的容量瓶;
(2)取适量黄色溶液,向其中加入少量KSCN溶液,若溶液变血红色,可证明溶液中含有Fe3+离子,从而证明假设2正确;
(3)利用还原剂的还原性大于还原产物,则可在含有Fe2+的溶液中滴加溴水,会发生离子反应Br2+2Fe2+=2Fe3++2Br-,即可证明还原性Fe2+>Br-;
(4)40mL0.1mol/LFeBr2溶液中溶质的物质的量是0.004mol ,通入3×10-3molC12,二者的物质的量比为4:3反应,结合还原性Fe2+>Br-,由氧化还原反应的先后规律和电子守恒可知,亚铁离子全部被氧化,溴离子只有四分子之一被氧化 ,发生反应的离子方程式为4Fe2+ +2Br-+3Cl2=4Fe3++Br2+6Cl-。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列图像正确反映对应变化关系的是
A. 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
B.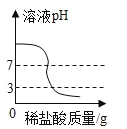 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C.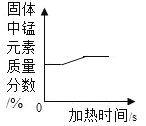 加热一定质量的高锰酸钾
加热一定质量的高锰酸钾
D.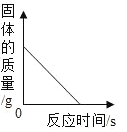 氢气还原一定质量的氧化铜
氢气还原一定质量的氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质及各种微量,分类法的作用几乎是无可替代的。
(1)下列7种微粒 ![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中有____种核素,含有____种元素,其中
中有____种核素,含有____种元素,其中 ![]() 与
与![]() ;____与____互称为____,
;____与____互称为____,![]() 、
、![]() 具有相同的____。
具有相同的____。
(2)现有以下8种物质:① Cu ② BaSO4晶体 ③熔融的NaCl ④Fe(OH)3胶体 ⑤纯硫酸 ⑥CO2 ⑦氯气 ⑧石灰水
①属于混合物的是(填序号,下同)____;
②能导电的单质是____;
③属于电解质的是____;
④属于非电解质的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ有反应:![]() 。
。
(1)________元素的化合价升高,则该元素的原子________电子,被________(填“氧化”或“还原”);而________元素的化合价降低,则该元素的原子________电子,被________(填“氧化”或“还原”)。
(2)该反应中Fe2O3发生了________反应,Al发生了________反应;______是氧化剂,______ 是还原剂,______是氧化产物,_____是还原产物。
Ⅱ.已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):![]()
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。A应该属于________(填字母)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)A物质可以使酸性KMnO4溶液褪色,此反应中(填化学式,下同)________失去电子,氧化剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是( )
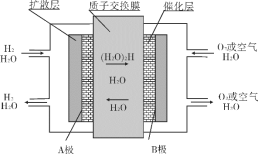
A. 可用一氧化碳、甲烷代替图中氢气和氧气(空气)形成质子交换膜燃料电池。
B. B极的电极反应式为:O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole时,通过质子交换膜的H+的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式____________。
,请写出此反应的热化学方程式____________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________________________。
(3)NO2用氨水吸收能生成NH4NO3,25℃时,将amolNH4NO3溶于水配成bL溶液,溶液显酸性,常温下向该溶液通入标准状况下VL氨气后溶液呈中性,则通入氨气的过程中水的电离平衡将_____(填“正向”“不”“逆向”)移动,通入标准状况下氨气的体积为_________L(设通入氨气后溶液的体积不变,用含a的代数式表示,已知常温下NH3·H2O的电离平衡常数为2.0×10-5)
(4)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
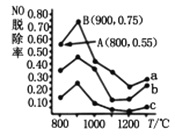
①由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________mg/(m3·s)。
③曲线c对应NH3与NO的物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
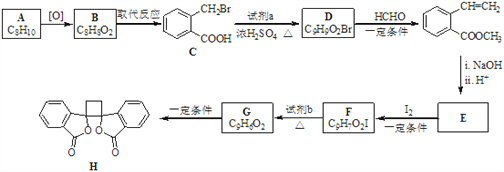
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()

(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成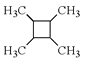 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com