
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式____________。
,请写出此反应的热化学方程式____________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________________________。
(3)NO2用氨水吸收能生成NH4NO3,25℃时,将amolNH4NO3溶于水配成bL溶液,溶液显酸性,常温下向该溶液通入标准状况下VL氨气后溶液呈中性,则通入氨气的过程中水的电离平衡将_____(填“正向”“不”“逆向”)移动,通入标准状况下氨气的体积为_________L(设通入氨气后溶液的体积不变,用含a的代数式表示,已知常温下NH3·H2O的电离平衡常数为2.0×10-5)
(4)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
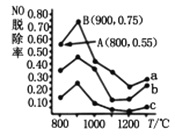
①由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________mg/(m3·s)。
③曲线c对应NH3与NO的物质的量之比是____________。
【答案】2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=–746.5kJ/mol HNO2-2e-+H2O=NO3-+3H+ 逆向
N2(g)+2CO2(g) △H=–746.5kJ/mol HNO2-2e-+H2O=NO3-+3H+ 逆向 ![]() 或0.112a 催化剂活性下降 1.5×10-4 1:3
或0.112a 催化剂活性下降 1.5×10-4 1:3
【解析】
(1)根据化学平衡常数的含义书写相应的化学反应方程式,然后根据盖斯定律将已知的三个热化学方程式进行叠加就可以得到待求反应的热化学方程式;
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该溶液,电解该溶液得到较浓的硝酸,说明是NO2-失去电子,发生还原反应,据此书写发生的电极反应;
(3)NH4NO3是强酸弱碱盐,在溶液中由于NH4+水解使溶液显酸性,向该溶液中通入氨气,导致NH3H2O浓度增大,根据盐水解平衡分析判断;先计算溶液中c(NH4+),利用电离平衡常数表达式计算出c(NH3H2O),NH3+H2O![]() NH3H2O,利用物质的量与气体体积关系计算;
NH3H2O,利用物质的量与气体体积关系计算;
(4)①根据温度与催化剂的活性关系分析判断;
②根据NO的脱除量变化值和脱除时间计算NO的脱出速率;
③两种反应物存在的反应,增大一种反应物的量可提高另一种反应物的转化率,据此分析。
(1)由于化学平衡常数是可逆反应达到化学平衡状态时,生成物浓度幂之积与反应物浓度幂之积的比,因此该反应的化学方程式为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
②C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
③2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
2×②-①-③,整理可得2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=–746.5kJ/mol;
N2(g)+2CO2(g) △H=–746.5kJ/mol;
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该溶液得到较浓的硝酸,是由于亚硝酸电离产生NO2-在阳极失去电子,发生氧化反应,电极反应式为:HNO2-2e-+H2O=NO3-+3H+;
(3)NH4NO3是强酸弱碱盐,在溶液中由于NH4+水解使溶液显酸性,向该溶液中通入氨气,导致c(NH3H2O)增大,导致化学平衡NH4++H2O![]() NH3H2O+H+逆向移动;若溶液显中性,则c(OH-)=10-7mol/L,c(NH4+)=
NH3H2O+H+逆向移动;若溶液显中性,则c(OH-)=10-7mol/L,c(NH4+)=![]() mol/L,c(NH3H2O)=
mol/L,c(NH3H2O)=![]() mol/L,K=
mol/L,K=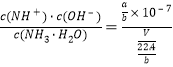 =2.0×10-5,解得V=
=2.0×10-5,解得V=![]() 或0.112a;
或0.112a;
(4)①根据图像可知:无论是在什么温度下,当温度超过900℃时NO脱除率都会骤然下降,是由于反应4NH3+6NO![]() 5N2+6H2O的正反应是在催化剂存在时进行,催化剂只有在一定温度范围内催化活性才最强,当温度超过900℃时NO脱除率都会骤然下降的原因是催化剂活性下降;
5N2+6H2O的正反应是在催化剂存在时进行,催化剂只有在一定温度范围内催化活性才最强,当温度超过900℃时NO脱除率都会骤然下降的原因是催化剂活性下降;
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,根据图象,NO的脱除率从55%上升到75%,则该段时间内NO的脱除量为△c=6×10-4mg/m3×(75%-55%)=1.2×10-4mg/m3,时间间隔为△t=0.8s,所以该段时间内NO的脱除速率为v=![]() =1.5×10-4 mg/(m3·s);
=1.5×10-4 mg/(m3·s);
③两种反应物存在的反应,增大一种反应物的量可提高另一种反应物的转化率,根据图象,曲线c的NO脱除率最低,即NO的转化率最低,所以NO的在总反应物中的比例最高,符合的是n(NH3):n(NO)的物质的量之比1:3。


科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)3.01×1023个氯气分子的物质的量是________________ ;
(2)4g金属钙的物质的量是________________;
(3)1molH2O的质量为________________;
(4)24g O2分子所含氧原子数目(用NA表示)________________;
(5)在标准状况下,33.6L NH3的物质的量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制240mL 1.00mol·L-1 Na2CO3溶液,请回答有关问题。
(1)配制时,下列4个操作的顺序是(用序号表示,每个操作只能用一次)____。
①将已冷却的Na2CO3溶液沿玻璃棒注入____中;
②用天平准确称取____g Na2CO3固体,加入少量蒸馏水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解;
③塞上瓶塞,颠倒摇匀;
④继续往容量瓶内小心加水,直到液面接近刻度____处,改用____加水至溶液凹液面与刻度线相切。
(2)按上述步骤配制的Na2CO3溶液的浓度____(选填“是”或“不是”)1.00mol·L-1,理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
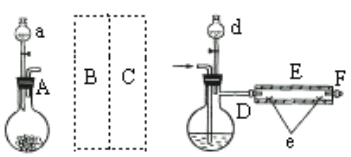
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
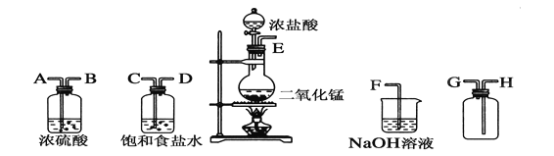
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。
②NaOH溶液中发生的反应:__________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在A处通入氯气,关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C 处的红布条逐渐褪色。有以下几种溶液,则D瓶中盛放的溶液可能是
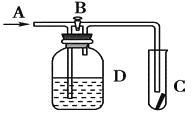
①浓硫酸 ②NaOH溶液 ③H2O ④饱和氯化钠溶液
A.①③B.①②C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某位同学设计的实验装置,制取 Cl2 并以 Cl2 为原料制备纯净的无水 FeCl3粉末。已知:无水 FeCl3 遇水强烈反应。

(1)A 为氯气发生装置,写出反应的化学方程式:_____。
(2)装置 B 的作用是_____。
(3)实验时需要用到下列所有操作:a.点燃 A 处的酒精灯;b.打开分液漏斗旋塞,放入浓盐酸;c.点燃 D 处的酒精灯;d.检查装置气密性。
请给出上述操作的正确顺序_____(填字母)
(4)D 中实验现象为_________。
(5)装置 E 中倒置漏斗作用是_____。
(6)某同学设计的上述实验装置示意图有一处不合理,请提出改进方案__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A.利用硝酸银溶液检验Cl﹣:Ag++Cl﹣=AgCl↓
B.向CuSO4溶液中滴加Ba(OH)2溶液:Ba2++SO42﹣=BaSO4↓
C.实验室用大理石块与稀盐酸制取CO2:CaCO3 + 2H+=Ca2++ CO2↑+ H2O
D.氯气溶解于水中:Cl2+H2O![]() H++Cl﹣+HClO
H++Cl﹣+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.物质的量浓度为0.5 mol/L的MgCl2溶液中含有NA个Cl-
C.标准状况下,11.2 L H2O含有的分子数为0.5 NA
D.在常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com