
����Ŀ��ijͬѧ����240mL 1.00mol��L��1 Na2CO3��Һ����ش��й����⡣
��1������ʱ������4��������˳���ǣ�����ű�ʾ��ÿ������ֻ����һ�Σ�____��
�ٽ�����ȴ��Na2CO3��Һ�ز�����ע��____�У�
������ƽȷ��ȡ____g Na2CO3���壬������������ˮ��Լ30mL�����ò������������裬ʹ�����ܽ⣻
������ƿ�����ߵ�ҡ�ȣ�
�ܼ���������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�____��������____��ˮ����Һ��Һ����̶������С�
��2���������������Ƶ�Na2CO3��Һ��Ũ��____��ѡ��������������������1.00mol��L-1��������____��
���𰸡��ڢ٢ܢ� 250mL����ƿ 26.5 �̶��� ��ͷ�ι� ���� ��ʵ��©��ϴ�Ӳ��������²���������ģ����ʵ����ʵ���ƫС������c=![]() ��֪������������Һ��Ũ��С��1.00molL-1��
��֪������������Һ��Ũ��С��1.00molL-1��
��������
��1���ٽ�����ȴ��Na2CO3��Һ�ز�����ע��250ml����ƿ�У�
������240mL 1.00molL-1 Na2CO3��Һ��Ҫ��250mL������ƿ����Ҫ����̼���Ƶ�����m=1mol/L��0.25L��106g/mol=26.5g��
�ܼ���������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶ȿ̶��ߴ������ý�ͷ�ιܼ�ˮ����Һ��Һ����̶������У�
˳��Ϊ���ڢ٢ܢۣ�
��2���������������Ƶ�Na2CO3��Һ��Ũ�Ȳ���1.00mol��L-1����ʵ��©��ϴ�Ӳ��������²���������ģ����ʵ����ʵ���ƫС������c=![]() ��֪������������Һ��Ũ��С��1.00molL-1��
��֪������������Һ��Ũ��С��1.00molL-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ������Ľ���ֵΪ6.02��1023����Ҫ�����������գ�
(1)1molCl2��Լ����______���������ӣ�Լ����______����ԭ�ӣ�����6.02��1023����ԭ�ӵ�H2SO4�����ʵ�����______��
(2)��״����11.2LN2O4��______molNO�����е�ԭ������ȡ�
(3)ij��������Һ�к���3.01��1023��Na+�������Һ��SO42-�����ʵ�����______��
(4)2L1mol/LMgCl2��þ���ӵ����ʵ���Ϊ______��Cl-�����ʵ���Ũ��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Fe3+��Fe2+����ʵ���˵���������

A. ����ͼװ�ÿ����Ʊ�����Fe(OH)2
B. ����FeCl3��Һʱ���Ƚ��Ȼ����������ڽ�Ũ�������У��ټ�ˮϡ�͵�����Ҫ��Ũ��
C. FeCl3��Һ�еμ�KSCN��Һ�����ɺ�ɫ����
D. ��FeCl2��Һ�м�������������Ϊ�˷�ֹFe2+������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǧ��ƵĻ�ѧ���ʼ������������෨�����ü�����������ġ�
��1������7���� ![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����____�ֺ��أ�����____��Ԫ�أ�����
����____�ֺ��أ�����____��Ԫ�أ����� ![]() ��
��![]() ��____��____����Ϊ____��
��____��____����Ϊ____��![]() ��
��![]() ������ͬ��____��
������ͬ��____��
��2����������8�����ʣ��� Cu �� BaSO4���塡�����ڵ�NaCl ��Fe(OH)3���� �ݴ����ᡡ��CO2�������� ��ʯ��ˮ
�����ڻ�������(����ţ���ͬ)____��
���ܵ���ĵ�����____��
�����ڵ���ʵ���____��
�����ڷǵ���ʵ���____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֹˮ����Ⱦ������ˮ�ʣ�������Ĵ�ʩ�ǿ��ƹ�ҵ��ˮ��������ˮ���ŷš���һ�ֹ�ҵ��ˮ����֪���к��д�����Fe2+��SO42����������Ag+��Na+���Լ��������ࡣijУ��ѧ��ȤС��ͬѧͨ�����в������̣��������ʣ�������ˮ��
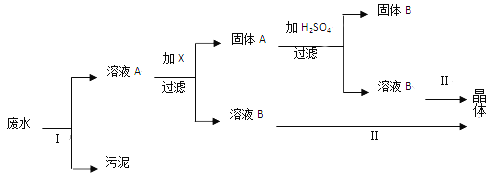
���������������̣��ش��������⣺
��1����ʵ���ҽ���������ʱ����Ҫ����Ҫ����������_______________��
��2����������������_____________��
��3������ҺA����Ҫ�������X��X��________________��������Ӧ�����ӷ���ʽΪ___________��
��4�������������յ��Ĺ���B��________________��������_________________�������վ�д���ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���ͳ�Ļ��̺��źܶ��ѧ֪ʶ������˵���������
A. ����ɰ(HgS��֮��ˮ���������ֻ��ɵ�ɰ���������ǿ��淴Ӧ
B. ��ˮ�������ʣ�ɳ·ѩ��ƽ��δ�漰��ѧ�仯
C. �����������Ѽ�·�������ݵ������������ܽ������ж����ЧӦ
D. ��������ע��¶����������ֹ������˵�������ǽ�����ζ������ֹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��![]() ��
��
��1��________Ԫ�صĻ��ϼ����ߣ����Ԫ�ص�ԭ��________���ӣ���________(����������������ԭ��)����________Ԫ�صĻ��ϼ۽��ͣ����Ԫ�ص�ԭ��________���ӣ���________(����������������ԭ��)��
��2���÷�Ӧ��Fe2O3������________��Ӧ��Al������________��Ӧ��______����������______ �ǻ�ԭ����______���������_____�ǻ�ԭ���
������֪ͭ��Ũ��������ڼ��������·������·�Ӧ(��Ӧ����ʽ����ƽ)��![]()
��ͨ����������������������⣺
��1��A���ʿ��Ե���������γɡ�AӦ������________(����ĸ)��
a���ᡡb���c���Ρ�d�����������e������������
��2��A���ʿ���ʹ����KMnO4��Һ��ɫ���˷�Ӧ��(�ѧʽ����ͬ)________ʧȥ���ӣ���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx(��ҪָNO��NO2)�Ǵ�����Ҫ��Ⱦ��֮һ����Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
(1)��֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) ��H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) ��H=-221 kJ/mol
��ij��Ӧ��ƽ�ⳣ������ʽΪK=![]() ����д���˷�Ӧ���Ȼ�ѧ����ʽ____________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ____________��
(2)��ϡ��������NOx���õ�HNO3��HNO2�Ļ����Һ�����û����Һ�ɻ�ý�Ũ�����ᡣд�����ʱ�����ĵ缫��Ӧʽ��_________________________��
(3)NO2�ð�ˮ����������NH4NO3��25��ʱ����amolNH4NO3����ˮ���bL��Һ����Һ�����ԣ������������Һͨ���״����VL��������Һ�����ԣ���ͨ�백���Ĺ�����ˮ�ĵ���ƽ�⽫_____(������������������������)�ƶ���ͨ���״���°��������Ϊ_________L(��ͨ�백������Һ��������䣬�ú�a�Ĵ���ʽ��ʾ����֪������NH3��H2O�ĵ���ƽ�ⳣ��Ϊ2.0��10-5)
(4)��������ȥ��NO����һ�������£���NH3����NO��Ⱦ���䷴Ӧԭ��Ϊ4NH3+6NO![]() 5N2+6H2O��ͬ�¶������£�n(NH3)��n(NO)�����ʵ���֮�ȷֱ�Ϊ4��1��3��1��1��3ʱ���õ�NO�ѳ���������ͼ��ʾ��
5N2+6H2O��ͬ�¶������£�n(NH3)��n(NO)�����ʵ���֮�ȷֱ�Ϊ4��1��3��1��1��3ʱ���õ�NO�ѳ���������ͼ��ʾ��
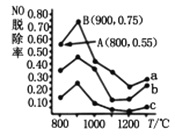
����ͼ��֪�������Ժ��ֱ�����Ӧ�����¶ȳ���900��ʱNO�ѳ��ʶ�����Ȼ�½���ԭ�������________��
������a��NO����ʼŨ��Ϊ6��10-4mg/m3����A�㵽B�㾭��0.8s����ʱ�����NO���ѳ�����Ϊ_____________mg/(m3��s)��
������c��ӦNH3��NO�����ʵ���֮����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ��A������B��ϡ����C��NaOH��ҺD��Ba(OH)2��Һ����Щ��Һ�������ʵ���Ũ�Ⱦ�Ϊ0.3mol/L��������Һȡ��������жϵõ�����Һ�д��ڵ���Ҫ���Ӽ���Ũ�ȣ����߸����������ӵ�������ƶ�������Һ��������Щ��Һ������������Ȼ�ϵĽ��(������Һ��Ϻ������仯)
��Һȡ����� | ��Һ�д��ڵ���Ҫ���Ӽ���Ũ�� |
��ҺA��B�������2:1��� | ��____________ |
��____________ | Na+��Cl�����ʵ���Ũ�Ⱦ�Ϊ0.15 mol/L |
����������ҺB��C | ��____________ |
��ҺA��D�������2:1��� | ��____________ |
��____________ | Ba2+���ʵ���Ũ��Ϊ0.1 mol/L��OH�����ʵ���Ũ��Ϊ0.2 mol/L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com