
����Ŀ������������Һ��A������B��ϡ����C��NaOH��ҺD��Ba(OH)2��Һ����Щ��Һ�������ʵ���Ũ�Ⱦ�Ϊ0.3mol/L��������Һȡ��������жϵõ�����Һ�д��ڵ���Ҫ���Ӽ���Ũ�ȣ����߸����������ӵ�������ƶ�������Һ��������Щ��Һ������������Ȼ�ϵĽ��(������Һ��Ϻ������仯)
��Һȡ����� | ��Һ�д��ڵ���Ҫ���Ӽ���Ũ�� |
��ҺA��B�������2:1��� | ��____________ |
��____________ | Na+��Cl�����ʵ���Ũ�Ⱦ�Ϊ0.15 mol/L |
����������ҺB��C | ��____________ |
��ҺA��D�������2:1��� | ��____________ |
��____________ | Ba2+���ʵ���Ũ��Ϊ0.1 mol/L��OH�����ʵ���Ũ��Ϊ0.2 mol/L |
���𰸡�H+���ʵ���Ũ��Ϊ0.4 mol/L��Cl�����ʵ���Ũ��Ϊ0.2 mol/L��SO42�����ʵ���Ũ��Ϊ0.1 mol/L ����������ҺA��C H+��Na+��SO42�����ʵ���Ũ�Ⱦ�Ϊ0.15 mol/L Ba2+���ʵ���Ũ��Ϊ0.1 mol/L��Cl�����ʵ���Ũ��Ϊ0.2 mol/L ��ҺB��D�������2:1���
��������
���ݸ���Һ������Ũ�ȵĴ�С�������㣬��������n=cV��
����ҺA�����Bϡ���ᰴ�����2:1��ϣ�����ǿ�ᣬ��������Ӧ����H+���ʵ���Ũ��Ϊ![]() =0.4 mol/L��Cl�����ʵ���Ũ��Ϊ
=0.4 mol/L��Cl�����ʵ���Ũ��Ϊ![]() 0.2 mol/L��SO42�����ʵ���Ũ��Ϊ
0.2 mol/L��SO42�����ʵ���Ũ��Ϊ![]() 0.1 mol/L��
0.1 mol/L��
�ڸ��ݻ�Ϻ�Na+��Cl�����ʵ���Ũ�Ⱦ�Ϊ0.15 mol/LΪA������Cl�����ʵ���Ũ��0.3mol/L��һ�룬Ҳ��C.NaOH��Һ��Na+���ʵ���Ũ�ȵ�һ�룬��Ϊ����������ҺA��C��
�۵���������ҺB(ϡ����)��C(NaOH��Һ)����Ӧ�������������ƺ�ˮ��H+��Na+��SO42�����ʵ���Ũ�Ⱦ�Ϊԭ����һ�룬��Ϊ![]() =0.15 mol/L��
=0.15 mol/L��
����ҺA��D�������2:1��ϣ���Ӧ�������Ȼ�����ˮ��Ba2+���ʵ���Ũ��Ϊ![]() 0.1 mol/L��Cl�����ʵ���Ũ��Ϊ
0.1 mol/L��Cl�����ʵ���Ũ��Ϊ![]() 0.2 mol/L��
0.2 mol/L��
�ݸ��ݻ�Ϻ���Һ��Ba2+���ʵ���Ũ��Ϊ0.1 mol/L��OH�����ʵ���Ũ��Ϊ0.2 mol/L����Ba2+���ʵ���Ũ��Ϊԭ����![]() ��OH�����ʵ���Ũ��Ϊԭ����
��OH�����ʵ���Ũ��Ϊԭ����![]() ���ұ���1��2������Һ�������
���ұ���1��2������Һ�������![]() ������������Ba2+��OH����������Ϊϡ���ᣬ����ҺB��D�������2:1��ϡ�
������������Ba2+��OH����������Ϊϡ���ᣬ����ҺB��D�������2:1��ϡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����240mL 1.00mol��L��1 Na2CO3��Һ����ش��й����⡣
��1������ʱ������4��������˳���ǣ�����ű�ʾ��ÿ������ֻ����һ�Σ�____��
�ٽ�����ȴ��Na2CO3��Һ�ز�����ע��____�У�
������ƽȷ��ȡ____g Na2CO3���壬������������ˮ��Լ30mL�����ò������������裬ʹ�����ܽ⣻
������ƿ�����ߵ�ҡ�ȣ�
�ܼ���������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�____��������____��ˮ����Һ��Һ����̶������С�
��2���������������Ƶ�Na2CO3��Һ��Ũ��____��ѡ��������������������1.00mol��L-1��������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijλͬѧ��Ƶ�ʵ��װ�ã���ȡ Cl2 ���� Cl2 Ϊԭ���Ʊ���������ˮ FeCl3��ĩ����֪����ˮ FeCl3 ��ˮǿ�ҷ�Ӧ��

��1��A Ϊ��������װ�ã�д����Ӧ�Ļ�ѧ����ʽ��_____��
��2��װ�� B ��������_____��
��3��ʵ��ʱ��Ҫ�õ��������в�����a����ȼ A ���ľƾ��ƣ�b����Һ©������������Ũ���c����ȼ D ���ľƾ��ƣ�d�����װ�������ԡ�
�����������������ȷ˳��_____������ĸ��
��4��D ��ʵ������Ϊ_________��
��5��װ�� E �е���©��������_____��
��6��ijͬѧ��Ƶ�����ʵ��װ��ʾ��ͼ��һ����������������Ľ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ���ǣ� ��
A.������������Һ����Cl����Ag++Cl����AgCl��
B.��CuSO4��Һ�еμ�Ba(OH)2��Һ��Ba2++SO42����BaSO4��
C.ʵ�����ô���ʯ����ϡ������ȡCO2��CaCO3 + 2H+��Ca2++ CO2��+ H2O
D.�����ܽ���ˮ�У�Cl2+H2O![]() H++Cl��+HClO
H++Cl��+HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4��ʱ��100mLˮ���ܽ���33.6L(STP)HCl���壬���������ܶ�Ϊ1.18g��mL��1�������й�˵������ȷ���ǣ� ��
A.����������ʵ���Ũ��Ϊ15mol��L��1
B.���������ʵ���������Ϊ35.4%
C.���¶���HCl���ܽ�ȿ��ܴ���336(�����ܽ��������ȼ���)
D.��ͬ�����£�һ����ˮ���ܽ�HCl����Խ�࣬���������ܶ�Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Է�������Ϊ26����A����һ����Ҫ���л�����ԭ�ϣ���AΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת��Ϊ��B����C��B��C����˴Ź�������ʾ��ֻ��һ���⣬��B������̼̼���ļ��������֡���CΪԭ��ͨ�����з��������Ʊ����й���ЧʳƷ�������õ��л���M��M���ӵ����ģ����ͼ��ʾ��
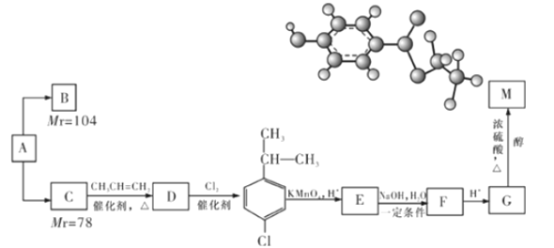
����������Ϣ���ش��������⣺
��1��B��ʹ������Ȼ�̼��Һ��ɫ����B�Ľṹ��ʽΪ____________��B������ʵ���Br2����ʱ������_________�ֲ��
��2��C��D�ķ�Ӧ����Ϊ______________________��
��3��д��E��F�Ļ�ѧ����ʽ_______________________________��
��4��G�����еĺ��������ŵ�������______________��д����G��Ӧ���ɸ߷��ӵĻ�ѧ��Ӧ����ʽ___________________________��
��5��M��ͬ���칹���ж��֣�д��������������������ͬ���칹��Ľṹ��ʽ��
���ܷ���������Ӧ�ں��б����ұ�����һ��ȡ���������֢���FeCl3��Һ������ɫ��1mol���л������������Ʒ�Ӧ����1mol������һ��̼ԭ����ͬʱ����������OH�Ľṹ���ȶ���_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ���������ѽ�ɰ����ַ�ʽ���У�C4H10![]() C2H6+C2H4��C4H10
C2H6+C2H4��C4H10![]() CH4+C3H6����ͼ��ij��ѧ��ȤС����ж����ѽ��ʵ�����̡�(ע��CuO�ܽ���������CO2��H2O��G����װ��������أ�ʡ��)
CH4+C3H6����ͼ��ij��ѧ��ȤС����ж����ѽ��ʵ�����̡�(ע��CuO�ܽ���������CO2��H2O��G����װ��������أ�ʡ��)
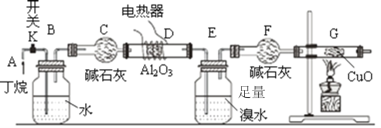
����ͼ����װ�ú�����е�ʵ������У��ٸ�D��Gװ�ü��ȣ��ڼ������װ�õ������ԣ����ų�װ���еĿ�����
���������������Ⱥ�˳��������_______________________��
��д������F������__________��д������������ͭ��Ӧ�Ļ�ѧ����ʽ_________
��Bװ�������������_____________________________��
�ȷ�Ӧ�������Eװ���еĻ������������̽���ʵ�飺
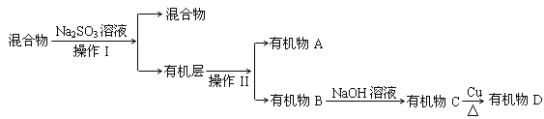
�ش��������⣺
�ٲ���I������II�ֱ��� ____________��____________
����֪D����˴Ź�����ͼ��ֻ��һ�ַ壬��D�Ľṹ��ʽ____________
��Na2SO3��Һ��������______________
(5)�ٶ�������ȫ�ѽ⣬��(E+F)װ�õ��������ȷ�Ӧǰ������0.7g��Gװ�õ�����������1.76g��������ѽ�����м������������ʵ���֮��n (CH4):n(C2H6)=______(�ٶ�����D��Gװ���е���������ȫ��Ӧ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����(����)
A.����NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2 L
B.���ʵ���Ũ��Ϊ0.5 mol/L��MgCl2��Һ�к���NA��Cl-
C.��״���£�11.2 L H2O���еķ�����Ϊ0.5 NA
D.�ڳ��³�ѹ�£�1.06 g Na2CO3���е�Na+��Ϊ0.02 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����о�������ѧ��չ��ռ�ж��ص�λ�á���Ԫ����10B �� 11B ������Ȼ�ȶ���ͬλ�أ��ڻ�̬ 11B ԭ���У��������______������״̬�෴�ĵ��ӣ���_______�ֲ�ͬ�ռ��˶�״̬�ĵ��ӡ����ݶԽ��߹�����Ԫ������������_____Ԫ�����ƣ�
(2)NH3 ��ͨ����λ������Ԫ�ص�ij���⻯�����õõ�������M��M��һ���µĴ�����ϣ�����M�Ỻ���ͷų�H2����ת��Ϊ������N��M��N�ֱ������顢��ϩ�ĵȵ����塣 M�ĽṹʽΪ______________(������λ��)��N�����е�������������Ŀ֮��Ϊ_______________��
(3)O �� S ����Ԫ������Ȼ�����������Ԫ�ء������� H �γ� H2O2 �� H2S2���ṹ��ͼ��ʾ����˵�� H2O2 �� ��H-O-O = 97�� �Դ��� ��H-S-S = 95�� ��ԭ�� ______________��


(4)��ͼΪDNA�ṹ�ֲ�ͼ��˫��ͨ�����ʹ���ǵļ��(A T �� C G )�����γ�˫�����ṹ����д��ͼ�д��ڵ���������ı�ʾʽ____________��_____________��

(5)ͨ����Ϊ�������ͨʽ��д�� (HO)mROn ��nֵԽ�ߣ�������Խǿ����ʵ���ϣ�������̼��ˮ��Һ���Ժ�����ͨ����Ϊ�����ᣬ������(H3PO4)�ķ��ǻ���������̼��(H2CO3)��ͬ��ȴ����ǿ�ᣬ�����ԭ��____________________��
(6)һ���¶��£�NiO��������Է��ط�ɢ���γ��������Ӳ�����������ΪO2�����õ������У�Ni2+ ������У���֪O2�İ뾶Ϊam�������ӵ�����NA����ÿƽ�����Ϸ�ɢ�ĸþ��������Ϊ_______________g��(д������ʽ���ɡ�ͼ�д�����ʾO2��С�����ʾ Ni2+)

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com