
����Ŀ��������һ���������ѽ�ɰ����ַ�ʽ���У�C4H10![]() C2H6+C2H4��C4H10
C2H6+C2H4��C4H10![]() CH4+C3H6����ͼ��ij��ѧ��ȤС����ж����ѽ��ʵ�����̡�(ע��CuO�ܽ���������CO2��H2O��G����װ��������أ�ʡ��)
CH4+C3H6����ͼ��ij��ѧ��ȤС����ж����ѽ��ʵ�����̡�(ע��CuO�ܽ���������CO2��H2O��G����װ��������أ�ʡ��)
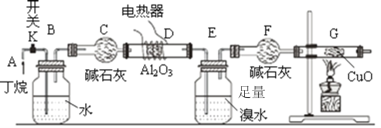
����ͼ����װ�ú�����е�ʵ������У��ٸ�D��Gװ�ü��ȣ��ڼ������װ�õ������ԣ����ų�װ���еĿ�����
���������������Ⱥ�˳��������_______________________��
��д������F������__________��д������������ͭ��Ӧ�Ļ�ѧ����ʽ_________
��Bװ�������������_____________________________��
�ȷ�Ӧ�������Eװ���еĻ������������̽���ʵ�飺
�ش��������⣺
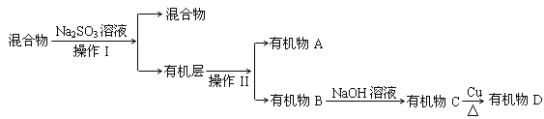
�ٲ���I������II�ֱ��� ____________��____________
����֪D����˴Ź�����ͼ��ֻ��һ�ַ壬��D�Ľṹ��ʽ____________
��Na2SO3��Һ��������______________
(5)�ٶ�������ȫ�ѽ⣬��(E+F)װ�õ��������ȷ�Ӧǰ������0.7g��Gװ�õ�����������1.76g��������ѽ�����м������������ʵ���֮��n (CH4):n(C2H6)=______(�ٶ�����D��Gװ���е���������ȫ��Ӧ)
���𰸡��� �� �� ���θ���� CH4+4CuO��CO2+2H2O+4Cu �۲졢���ƶ������������ ��Һ������ OHC-CHO ��ȥ�л������ܽ��Br2 1:1
��������
��1�����ȱ������װ�õ������ԣ�Ϊ�˷�ֹ��������������ը�����ڼ���ǰ��Ҫ�ų�ϵͳ�ڵĿ�����
��2������F���������θ���ܣ�������CuO�ķ�Ӧ��CuO����ԭΪͭ���ʣ�ͨ��ԭ���غ���ƽ��Ӧ��
��3��ͨ���۲�Bװ�������ݵĿ���������ͨ��Ķ�������ʣ�
��4�����������Na2SO3��Һ��ȥ�������壻���Һ��Ϊ�л�����ˮ�㣬��Һ���л������Ҫ�ɷ�Ϊ��CH2Br��CH2Br��CH2Br��CHBrCH3�����������ʷе�IJ�ͬ������ֿ��������⣬D����˴Ź�����ͼ��ֻ��һ�ַ壬ȷ��D�Ľṹ��ʽ��
��5����ϸ����װ�ø��������仯���㡣
��1�����ȱ������װ�õ������ԣ�Ϊ�˷�ֹ��������������ը�����ڼ���ǰ��Ҫ�ų�ϵͳ�ڵĿ��������Դ�����������˳��Ϊ���ڢۢ٣�
�𰸣��ڢۢ�
��2������F���������θ���ܣ�������CuO�ķ�Ӧ��CuO����ԭΪͭ���ʣ�ͨ��ԭ���غ����ƽ��Ӧ��CH4+4CuO��CO2+2H2O+4Cu��
�𰸣����θ���� CH4+4CuO��CO2+2H2O+4Cu
��3��ͨ���۲�Bװ�������ݵĿ���������ͨ��Ķ�������ʣ�
�𰸣��۲졢���ƶ������������
��4���ѽ������ϩ����ϩ���巢���ӳɷ�Ӧ��CH2=CH2+Br2��CH2Br��CH2Br��CH2=CHCH3+Br2��CH2Br��CHBrCH3�����������Na2SO3��Һ��ȥ�������壺Br2��Na2SO3��H2O=Na2SO4��2HBr�����Һ��Ϊ�л�����ˮ�㣻��Һ���л������Ҫ�ɷ�Ϊ��CH2Br��CH2Br��CH2Br��CHBrCH3�����������ʷе�IJ�ͬ������ֿ����ֱ����������ˮ�⡢��������CH2Br��CH2Br��CH2OH��CH2OH��OHC-CHO��CH2Br��CHBrCH3��CH2OH��CH��OH��CH3��OHC��CO��CH3�����⣬D����˴Ź�����ͼ��ֻ��һ�ַ壬��D�Ľṹ��ʽOHC-CHO�����ݷ����ش�����
�ٲ���I������II�ֱ��� ��Һ������
�𰸣���Һ������
����֪D����˴Ź�����ͼ��ֻ��һ�ַ壬��D�Ľṹ��ʽOHC-CHO��
�𰸣�OHC-CHO
��Na2SO3��Һ�������dz�ȥ�л������ܽ��Br2��
�𰸣���ȥ�л������ܽ��Br2
��5��C4H10��C2H6+C2H4�� C4H10 ��CH4+C3H6
�趡���ѽ�����к���xmol���顢��ϩ��ymol���顢��ϩ��
(E+F)װ�����ӵ�����������ϩ����������42x+28y=0.7��
G��CH4+4CuO��CO2+2H2O+4Cu C2H6+7CuO��2CO2+3H2O+7Cu
Gװ�ü��ٵ�������CuOʧȥ����������64x+112y=1.76
���x=y=0.01mol
�ʶ�����ѽ�����м������������ʵ���֮��n (CH4) : n (C2H6) =1��1��
�𰸣�1:1


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��![]() ��
��
��1��________Ԫ�صĻ��ϼ����ߣ����Ԫ�ص�ԭ��________���ӣ���________(����������������ԭ��)����________Ԫ�صĻ��ϼ۽��ͣ����Ԫ�ص�ԭ��________���ӣ���________(����������������ԭ��)��
��2���÷�Ӧ��Fe2O3������________��Ӧ��Al������________��Ӧ��______����������______ �ǻ�ԭ����______���������_____�ǻ�ԭ���
������֪ͭ��Ũ��������ڼ��������·������·�Ӧ(��Ӧ����ʽ����ƽ)��![]()
��ͨ����������������������⣺
��1��A���ʿ��Ե���������γɡ�AӦ������________(����ĸ)��
a���ᡡb���c���Ρ�d�����������e������������
��2��A���ʿ���ʹ����KMnO4��Һ��ɫ���˷�Ӧ��(�ѧʽ����ͬ)________ʧȥ���ӣ���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���� ( )
A. �ױ��ȿ�ʹ������Ȼ�̼��Һ��Ӧ����ɫ��Ҳ��ʹ���Ը��������Һ��ɫ
B. �л���![]() ����ȥ����������
����ȥ����������
C. �л���A(C4H6O2)�ܷ����Ӿ۷�Ӧ������֪A�Ľṹһ����CH2=CH��COOCH3
D. ������ˮ���𱽡����Ȼ�̼������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ��A������B��ϡ����C��NaOH��ҺD��Ba(OH)2��Һ����Щ��Һ�������ʵ���Ũ�Ⱦ�Ϊ0.3mol/L��������Һȡ��������жϵõ�����Һ�д��ڵ���Ҫ���Ӽ���Ũ�ȣ����߸����������ӵ�������ƶ�������Һ��������Щ��Һ������������Ȼ�ϵĽ��(������Һ��Ϻ������仯)
��Һȡ����� | ��Һ�д��ڵ���Ҫ���Ӽ���Ũ�� |
��ҺA��B�������2:1��� | ��____________ |
��____________ | Na+��Cl�����ʵ���Ũ�Ⱦ�Ϊ0.15 mol/L |
����������ҺB��C | ��____________ |
��ҺA��D�������2:1��� | ��____________ |
��____________ | Ba2+���ʵ���Ũ��Ϊ0.1 mol/L��OH�����ʵ���Ũ��Ϊ0.2 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10mL0.1mol��L-1 NH4Al(SO4)2��Һ��,�μӵ�Ũ��Ba(OH)2��ҺxmL������������ȷ���ǣ� ��
A. x=10ʱ����Һ����NH4+��Al3+��SO42-����c(NH4+)��c(SO42-)
B. x=10ʱ����Һ����NH4+��AlO2-��SO42-����c(NH4+)��c(Al3+)
C. x=30ʱ����Һ����Ba2+��AlO2-��OH-����c(OH-)��c(Ba2+)
D. x=30ʱ����Һ����Ba2+��AlO2-��OH-����c(OH-)��c(AlO2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ʵ�����Ʊ����������Ļ�ѧ����ʽ��CH3COOH��C2H5OH![]() CH3COOC2H5��H2O��Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴��������ռ������ã�ijͬѧ������ͼ��ʾװ�ý����������ĸ�ʵ�飬ʵ�鿪ʼ���þƾ�����3 min���ټ���ʹ֮����3min��ʵ������������Թܢ��ٲ��л���ĺ�ȣ�ʵ���¼���£�
CH3COOC2H5��H2O��Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴��������ռ������ã�ijͬѧ������ͼ��ʾװ�ý����������ĸ�ʵ�飬ʵ�鿪ʼ���þƾ�����3 min���ټ���ʹ֮����3min��ʵ������������Թܢ��ٲ��л���ĺ�ȣ�ʵ���¼���£�
ʵ���� | �Թܢ��е��Լ� | �Թܢ����Լ� | ����л���ĺ��/cm |
A | 2 mL�Ҵ���2 mL���ᡢ1 mL 18 mol��L��1Ũ���� | ����̼���� ��Һ | 5.0 |
B | 3 mL�Ҵ���2 mL���� | 0.1 | |
C | 3 mL�Ҵ���2 mL���ᡢ6mL 3 mol��L��1���� | 1.2 | |
D | 3 mL�Ҵ���2 mL���ᡢ���� | 1.2 |
��1��ʵ��D��Ŀ������ʵ��C����գ�֤��H����������Ӧ���д����á�ʵ��D��Ӧ��������������Ũ�ȷֱ���________mL��________mol/L��
��2������ʵ��________����ʵ���ţ������ݣ������Ʋ��Ũ�������ˮ����������������IJ��ʡ�Ũ�������ˮ���ܹ���������������ʵ�ԭ����_____________________��
��3������������������������IJ��ʣ���ʵ�鷢���¶ȹ������������IJ��ʷ������ͣ����ܵ�ԭ����______________������������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���Ʊ����о���Ȳ���ʵ�ʵ��װ��ͼ���й�˵����ȷ���ǣ� ��
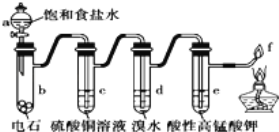
A. ������ˮ���a�б���ʳ��ˮ��������Ȳ��Ϊ����
B. c���������������dz�ȥӰ�����ʵ�������
C. d��e��ɫԭ����ͬ
D. f��������������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Mg��Al�Ļ����Ͷ��500 mLϡ�����У�����ȫ���ܽⲢ�������塣����Ӧ��ȫ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ����ͼ��ʾ��������˵����ȷ����( )

A��Mg��Al��������Ϊ8 g
B��ԭϡ������Һ�����ʵ���Ũ��Ϊ5 mol��L��1
C�����ɵ�H2�ڱ�״���µ����Ϊ11.2 L
D��NaOH��Һ�����ʵ���Ũ��Ϊ5 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ͼ��ʾʵ��װ�ý�������ˮ������Ӧ��ʵ�飬���Է�Ӧ��Ӳ���Թ��й������ʵ���ɽ�����̽����
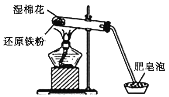
��ش��������⣺
��1��Ӳ���Թ���ʪ����������________________��
��2������ˮ�����ķ�Ӧ�У���������________���ѧʽ����ͬ������ԭ����________��
��3����ͬѧ�Է�Ӧ��Ӳ���Թ��й������ʵ������������¼��裺
����1��ֻ��Fe��
����2��ֻ��________��
����3������FeҲ��Fe3O4��
��4��Ϊ����֤��Ӧ��Ӳ���Թ��й������ʵ���ɣ���ͬѧ�����˶����о�����Ӧǰ�������ʵ�����Ϊ5.6 g����Ӧ��������ʵ�����Ϊ6.6 g�����������ݷ�������Ӧ��Ӳ���Թ��й������ʵ����Ϊ__________________��д���÷�Ӧ�Ļ�ѧ����ʽ________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com