
【题目】某同学利用如图所示实验装置进行铁与水蒸气反应的实验,并对反应后硬质试管中固体物质的组成进行了探究。
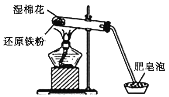
请回答下列问题:
(1)硬质试管中湿棉花的作用是________________。
(2)铁与水蒸气的反应中,氧化剂是________(填化学式,下同),还原剂是________。
(3)该同学对反应后硬质试管中固体物质的组成提出了如下假设:
假设1:只有Fe;
假设2:只有________;
假设3:既有Fe也有Fe3O4。
(4)为了验证反应后硬质试管中固体物质的组成,该同学进行了定量研究:反应前固体物质的质量为5.6 g,反应后固体物质的质量为6.6 g。从上述数据分析,反应后硬质试管中固体物质的组成为__________________。写出该反应的化学方程式________________________
【答案】提供水蒸气 H2O Fe Fe3O4 Fe和Fe3O4 3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
【解析】
铁与水蒸气反应生成四氧化三铁与氢气。
(1)硬质试管中的湿棉花受热时可产生水蒸气,故硬质试管中湿棉花的作用是提供反应需要的水蒸气。
(2)根据化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe在反应中失去电子作还原剂,H2O在反应中得到电子作氧化剂。
Fe3O4+4H2,Fe在反应中失去电子作还原剂,H2O在反应中得到电子作氧化剂。
(3)若Fe没有反应,则固体物质为Fe;若Fe部分反应,则固体物质为Fe与Fe3O4的混合物;若Fe全部反应,则固体物质为Fe3O4。
(4)若5.6 g Fe完全反应,应得到![]() mol Fe3O4,其质量约为7.7 g,而实验测得反应后固体物质的质量为6.6 g,说明Fe部分反应,故反应后的硬质试管中固体物质为Fe和Fe3O4的混合物;该反应的化学方程式为:3Fe+4H2O(g)
mol Fe3O4,其质量约为7.7 g,而实验测得反应后固体物质的质量为6.6 g,说明Fe部分反应,故反应后的硬质试管中固体物质为Fe和Fe3O4的混合物;该反应的化学方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2。
Fe3O4+4H2。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】丁烷在一定条件下裂解可按两种方式进行:C4H10![]() C2H6+C2H4,C4H10
C2H6+C2H4,C4H10![]() CH4+C3H6,下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)
CH4+C3H6,下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)
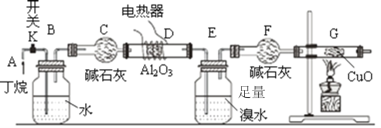
按上图连好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等
⑴这三步操作的先后顺序依次是_______________________。
⑵写出仪器F的名称__________,写出甲烷与氧化铜反应的化学方程式_________
⑶B装置所起的作用是_____________________________。
⑷反应结束后对E装置中的混合物,按以下流程进行实验:
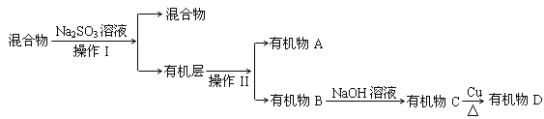
回答下列问题:
①操作I、操作II分别是 ____________、____________
②已知D的氢核磁共振谱图上只有一种峰,则D的结构简式____________
③Na2SO3溶液的作用是______________
(5)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7g,G装置的质量减少了1.76g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4):n(C2H6)=______(假定流经D、G装置中的气体能完全反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL 5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
A. Fe2O3B. Fe3O4C. Fe4O5D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硼的研究在无机化学发展中占有独特的位置。硼元素有10B 和 11B 两种天然稳定的同位素,在基态 11B 原子中,核外存在______对自旋状态相反的电子,有_______种不同空间运动状态的电子。根据对角线规则,硼元素许多性质与_____元素相似;
(2)NH3 能通过配位键与硼元素的某种氢化物作用得到化合物M,M是一种新的储氢材料,加热M会缓慢释放出H2,并转化为化合物N,M、N分别是乙烷、乙烯的等电子体。 M的结构式为______________(须标出配位键),N分子中的π键和σ键数目之比为_______________;
(3)O 和 S 两种元素是自然界最常见的两种元素。均能与 H 形成 H2O2 和 H2S2,结构如图所示。请说明 H2O2 中 ∠H-O-O = 97° 略大于 ∠H-S-S = 95° 的原因: ______________;


(4)下图为DNA结构局部图。双链通过氢键使它们的碱基(A T 和 C G )相互配对形成双螺旋结构,请写出图中存在的两种氢键的表示式____________,_____________;

(5)通常认为含氧酸的通式可写成 (HO)mROn ,n值越高,则酸性越强。可实际上,二氧化碳的水溶液酸性很弱,通常认为是弱酸,但磷酸(H3PO4)的非羟基氧个数与碳酸(H2CO3)相同,却是中强酸,请解释原因:____________________;
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2作密置单层排列,Ni2+ 填充其中;已知O2的半径为am,阿伏加德罗常数NA,则每平方米上分散的该晶体的质量为_______________g。(写出表达式即可。图中大白球表示O2,小黑球表示 Ni2+)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓盐酸所贴标签截图如下图所示,现用该浓盐酸配制250mL浓度为1mol/L的稀盐酸。试回答下列问题:

(1)该浓盐酸的浓度为_____________;
(2)经计算,宜选用下列中______(填字母)的量筒,量取_____(填计算结果)mL浓盐酸。
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释后的盐酸温度与室温一致后,沿玻璃棒将盐酸注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶颈刻度线下1~2 cm处,改用胶头滴管加蒸馏水,使溶液的凹液面最低处与刻度线相切。
③在盛浓盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶中。
上述操作中,正确的顺序是(填序号)___________________。
(4)在实际配制溶液的过程中,难免由于操作不当或操作错误而对所配溶液浓度产生影响,请分析下列情况对本实验所配制稀盐酸浓度的影响(填“偏高”、“偏低”或“无影响”):
①定容时俯视刻度线,会导致所配稀盐酸浓度_______;
②用刚刚洗涤干净的量筒来量取浓盐酸,会导致所配稀盐酸浓度__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时每转移3mol电子,正极有1molK2FeO4被氧化
B. 充电时阳极反应为:Fe(OH)3+5OH-3e-=FeO42-+4H2O
C. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示三个烧瓶中分别装入含酚酞的0.01 mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。

(1)含酚酞0.01mol/LCH3COONa溶液显浅红色的原因为________
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确_____
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3晶体溶于水时放出热量
D.NH4NO3晶体溶于水时吸收热量
(3)向0.01mol/LCH3COONa溶液中分别加入少量浓盐酸、Na2CO3固体,使CH3COO-水解平衡移动的方向分别为_____、____(填“左”、“右”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的分析正确的是
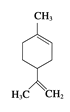
A.1mol柠檬烯可以和2molH2发生加成反应
B.它的分子中所有原子一定在同一平面上
C.它和丁基苯(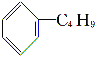 )互为同分异构体
)互为同分异构体
D.一定条件下,它分别可以发生加成、取代、氧化、加聚等反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com