
【题目】(1)硼的研究在无机化学发展中占有独特的位置。硼元素有10B 和 11B 两种天然稳定的同位素,在基态 11B 原子中,核外存在______对自旋状态相反的电子,有_______种不同空间运动状态的电子。根据对角线规则,硼元素许多性质与_____元素相似;
(2)NH3 能通过配位键与硼元素的某种氢化物作用得到化合物M,M是一种新的储氢材料,加热M会缓慢释放出H2,并转化为化合物N,M、N分别是乙烷、乙烯的等电子体。 M的结构式为______________(须标出配位键),N分子中的π键和σ键数目之比为_______________;
(3)O 和 S 两种元素是自然界最常见的两种元素。均能与 H 形成 H2O2 和 H2S2,结构如图所示。请说明 H2O2 中 ∠H-O-O = 97° 略大于 ∠H-S-S = 95° 的原因: ______________;


(4)下图为DNA结构局部图。双链通过氢键使它们的碱基(A T 和 C G )相互配对形成双螺旋结构,请写出图中存在的两种氢键的表示式____________,_____________;

(5)通常认为含氧酸的通式可写成 (HO)mROn ,n值越高,则酸性越强。可实际上,二氧化碳的水溶液酸性很弱,通常认为是弱酸,但磷酸(H3PO4)的非羟基氧个数与碳酸(H2CO3)相同,却是中强酸,请解释原因:____________________;
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2作密置单层排列,Ni2+ 填充其中;已知O2的半径为am,阿伏加德罗常数NA,则每平方米上分散的该晶体的质量为_______________g。(写出表达式即可。图中大白球表示O2,小黑球表示 Ni2+)

【答案】2 3 Si 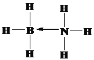 1:5 O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大 N—H O N—H N 溶于水的CO2分子只有约几百分之一与水结合成碳酸
1:5 O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大 N—H O N—H N 溶于水的CO2分子只有约几百分之一与水结合成碳酸 ![]() 或
或 ![]()
【解析】
(1)B为5号元素,在基态11B原子中,电子排布式为1s22s22p1,在周期表中,B与Si位于对角线位置,据此分析判断;
(2)M是NH3与硼元素的氢化物相互作用的产物,M是乙烷的等电子体,说明M中含有8个原子、价电子数是14,则M为BH3NH3;N是乙烯的等电子体,应为BH2=NH2,据此分析解答;
(3)O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,据此分析解答;
(4)根据图示判断存在的氢键;
(5)根据CO2溶于水的程度不大,且与水结合的CO2的数量更小分析解答;
(6) 根据图片知,平面NiO基本结构单元为![]() ,每个机构单元含有1个“NiO” ,首先计算每个氧化镍所占的面积和每个氧化镍的质量,再计算每平方米含有的氧化镍个数和含有的氧化镍质量。
,每个机构单元含有1个“NiO” ,首先计算每个氧化镍所占的面积和每个氧化镍的质量,再计算每平方米含有的氧化镍个数和含有的氧化镍质量。
(1)B为5号元素,在基态11B原子中,电子排布式为1s22s22p1,同一轨道中两个电子自旋方向相反,核外存在2对自旋状态相反的电子;核外电子空间运动状态由能层、能级、原子轨道决定,1s轨道、2s轨道、2p有1个轨道,有3种不同空间运动状态的电子;在周期表中,B与Si位于对角线位置,根据对角线规则,硼元素许多性质与Si元素相似,故答案为:2;3;Si;
(2)M是NH3与硼元素的氢化物相互作用的产物,M是乙烷的等电子体,说明M中含有8个原子、价电子数是14,则M为BH3NH3,M中B含有空轨道,N含有孤电子对,可形成配位键,M结构式为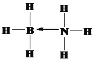 ;N是乙烯的等电子体,应为BH2=NH2,N分子中含有1个π键,σ键包括2个B-H、2个N-H和1个B-N,共5个,π键和σ键数目之比为1:5,故答案为:
;N是乙烯的等电子体,应为BH2=NH2,N分子中含有1个π键,σ键包括2个B-H、2个N-H和1个B-N,共5个,π键和σ键数目之比为1:5,故答案为: ;1:5;
;1:5;
(3)O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大,使得H2O2 中 ∠H-O-O 略大于 ∠H-S-S,故答案为:O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大;
(4)根据图示,图中存在的氢键的表示式为N—H O和N—H N,故答案为:N—H O;N—H N;
(5)H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸,由于CO2溶于水的程度不大,与水结合的CO2的数量更小,只有约几百分之一与水结合成碳酸,与按二氧化碳全部转化为碳酸分子来估算酸的强度相比,自然就小了近百倍了,故答案为:溶于水的二氧化碳分子只有约几百分之一与水结合成碳酸;
(6)根据图片知,平面NiO基本结构单元为![]() ,每个机构单元含有1个“NiO” ,每个氧化镍所占的面积=(2×am)×(2×am×sin60°)=2
,每个机构单元含有1个“NiO” ,每个氧化镍所占的面积=(2×am)×(2×am×sin60°)=2![]() a2m2,则每平方米含有的氧化镍个数=
a2m2,则每平方米含有的氧化镍个数=![]() ,每个氧化镍的质量=
,每个氧化镍的质量=![]() g,所以每平方米含有的氧化镍质量=
g,所以每平方米含有的氧化镍质量=![]() ×
×![]() g=
g=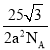 ,故答案为:
,故答案为: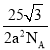 。
。


科目:高中化学 来源: 题型:
【题目】现有四种溶液:A.盐酸B.稀硫酸C.NaOH溶液D.Ba(OH)2溶液。这些溶液溶质物质的量浓度均为0.3mol/L。根据溶液取用情况,判断得到的溶液中存在的主要离子及其浓度;或者根据最终离子的情况,推断最终溶液可能是哪些溶液按怎样的体积比混合的结果(忽略溶液混合后的体积变化)
溶液取用情况 | 溶液中存在的主要离子及其浓度 |
溶液A和B按体积比2:1混合 | ①____________ |
②____________ | Na+和Cl﹣物质的量浓度均为0.15 mol/L |
等体积混合溶液B和C | ③____________ |
溶液A和D按体积比2:1混合 | ④____________ |
⑤____________ | Ba2+物质的量浓度为0.1 mol/L,OH﹣物质的量浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() (I)、
(I)、![]() (II)、
(II)、![]() (III)、
(III)、![]() (IV)化合物的说法正确的是
(IV)化合物的说法正确的是
A. Ⅰ、Ⅱ、Ⅲ、Ⅳ的沸点依次升高 B. Ⅰ、Ⅲ的一氯代物均只有四种
C. Ⅱ、Ⅲ中碳原子可能都处于同一平面 D. Ⅲ、Ⅳ都属于芳香族化合物,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬合金具有高硬度、耐腐蚀特性,广泛应用于精密仪器制造。由高碳铬铁合金废料粉末制取铬的简单流程如下:
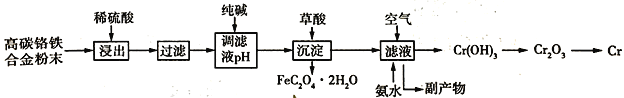
已知:Cr + H2SO4 = CrSO4 + H2↑
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有______________(合理、一条即可)
(2)用纯碱调节溶液酸度,若纯碱过量,则可能导致的后果是_________________,副产物直接排放环境不仅浪费,还污染水质。请你写出副产物的一个用途______________(合理给分)。
(3)加入草酸(H2C2O4)发生的离子方程式为__________________,铬属于难熔金属,写出工业中冶炼铬的化学方程式_________________。
(4)向滤液中通入空气,加入氨水后发生反应的化学方程式为_________________。
(5)已知高碳铬铁废料中铁铬元素质量之比为14:13。上述流程中铁元素转化为草酸亚铁的利用率为80%。废料中提取金属铬的总转化率为95%,如果得到草酸亚铁晶体(FeC2O42H2O)的质量为18.00 t ,则可以冶炼铬的质量为________t(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)该有机物的分子式_______________,A的链状同分异构体共有__________种。
(2)A的链状同分异构体中含有支链的同分异构体的结构简式为_______________,其系统命名为__________________
(3)若该有机物跟HCl的加成产物只有一种,试确定其结构简式___________________
(4)若该有机物在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示实验装置进行铁与水蒸气反应的实验,并对反应后硬质试管中固体物质的组成进行了探究。
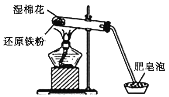
请回答下列问题:
(1)硬质试管中湿棉花的作用是________________。
(2)铁与水蒸气的反应中,氧化剂是________(填化学式,下同),还原剂是________。
(3)该同学对反应后硬质试管中固体物质的组成提出了如下假设:
假设1:只有Fe;
假设2:只有________;
假设3:既有Fe也有Fe3O4。
(4)为了验证反应后硬质试管中固体物质的组成,该同学进行了定量研究:反应前固体物质的质量为5.6 g,反应后固体物质的质量为6.6 g。从上述数据分析,反应后硬质试管中固体物质的组成为__________________。写出该反应的化学方程式________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年质检部门在众多品牌乳制品中检出有毒有机物三聚氰胺[C3N3(NH2)3],在乳制品行业掀起了一场轩然大波,引发了一场关于食品安全问题的大讨论。三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为:![]() ;
;![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. C3N3(OH)3与HNCO为同一物质B. HNCO是一种很强的氧化剂
C. 1mol NO2在反应中转移的电子为4molD. 反应中NO2是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com