
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.物质的量浓度为0.5 mol/L的MgCl2溶液中含有NA个Cl-
C.标准状况下,11.2 L H2O含有的分子数为0.5 NA
D.在常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
【答案】D
【解析】
A. 氦气为稀有气体,是单原子分子,含有NA个氦原子的氦气为1mol,在标准状况下的体积约为22.4 L,故A错误;
B. 物质的量浓度为0.5 mol/L的MgCl2溶液中未给出溶液的体积,不能计算溶液中溶质的物质的量,则氯离子的微粒数目无法计算,故B错误;
C. 标准状况下,11.2 L H2O为液体,不能用气体摩尔体积来计算物质的量,含有的分子数不等于0.5 NA
D. 1.06 g Na2CO3的物质的量为![]() =0.01mol,Na2CO3属于强电解质,溶液中完全电离,0.01molNa2CO3含有的Na+数为0.01mol ×2×NA mol-1=0.02 NA,故D正确;
=0.01mol,Na2CO3属于强电解质,溶液中完全电离,0.01molNa2CO3含有的Na+数为0.01mol ×2×NA mol-1=0.02 NA,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式____________。
,请写出此反应的热化学方程式____________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________________________。
(3)NO2用氨水吸收能生成NH4NO3,25℃时,将amolNH4NO3溶于水配成bL溶液,溶液显酸性,常温下向该溶液通入标准状况下VL氨气后溶液呈中性,则通入氨气的过程中水的电离平衡将_____(填“正向”“不”“逆向”)移动,通入标准状况下氨气的体积为_________L(设通入氨气后溶液的体积不变,用含a的代数式表示,已知常温下NH3·H2O的电离平衡常数为2.0×10-5)
(4)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
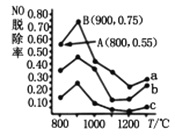
①由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________mg/(m3·s)。
③曲线c对应NH3与NO的物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种溶液:A.盐酸B.稀硫酸C.NaOH溶液D.Ba(OH)2溶液。这些溶液溶质物质的量浓度均为0.3mol/L。根据溶液取用情况,判断得到的溶液中存在的主要离子及其浓度;或者根据最终离子的情况,推断最终溶液可能是哪些溶液按怎样的体积比混合的结果(忽略溶液混合后的体积变化)
溶液取用情况 | 溶液中存在的主要离子及其浓度 |
溶液A和B按体积比2:1混合 | ①____________ |
②____________ | Na+和Cl﹣物质的量浓度均为0.15 mol/L |
等体积混合溶液B和C | ③____________ |
溶液A和D按体积比2:1混合 | ④____________ |
⑤____________ | Ba2+物质的量浓度为0.1 mol/L,OH﹣物质的量浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备和研究乙炔性质的实验装置图,有关说法正确的是( )
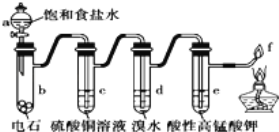
A. 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净
B. c(过量)的作用是除去影响后续实验的杂质
C. d、e褪色原理相同
D. f处产生明亮的蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )

A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() (I)、
(I)、![]() (II)、
(II)、![]() (III)、
(III)、![]() (IV)化合物的说法正确的是
(IV)化合物的说法正确的是
A. Ⅰ、Ⅱ、Ⅲ、Ⅳ的沸点依次升高 B. Ⅰ、Ⅲ的一氯代物均只有四种
C. Ⅱ、Ⅲ中碳原子可能都处于同一平面 D. Ⅲ、Ⅳ都属于芳香族化合物,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com