
����Ŀ����������ǧ��ƵĻ�ѧ���ʼ������������෨�����ü�����������ġ�
��1������7���� ![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����____�ֺ��أ�����____��Ԫ�أ�����
����____�ֺ��أ�����____��Ԫ�أ����� ![]() ��
��![]() ��____��____����Ϊ____��
��____��____����Ϊ____��![]() ��
��![]() ������ͬ��____��
������ͬ��____��
��2����������8�����ʣ��� Cu �� BaSO4���塡�����ڵ�NaCl ��Fe(OH)3���� �ݴ����ᡡ��CO2�������� ��ʯ��ˮ
�����ڻ�������(����ţ���ͬ)____��
���ܵ���ĵ�����____��
�����ڵ���ʵ���____��
�����ڷǵ���ʵ���____��
���𰸡�5 4 ![]()
![]() ͬλ�� ������ �ܢ� �� �ڢۢ� ��
ͬλ�� ������ �ܢ� �� �ڢۢ� ��
��������
��1��Ԫ�ؾ��Ǿ�����ͬ�ĺ˵����������������������һ��ԭ�ӵ��ܳƣ�������ָ����һ����Ŀ���Ӻ�һ����Ŀ���ӵ�һ��ԭ�ӣ�������ͬ����������ͬ������ͬһԪ�صIJ�ͬ���ػ�Ϊͬλ�أ�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����5�ֺ��أ�����H��C��N��O��4��Ԫ�أ�
����5�ֺ��أ�����H��C��N��O��4��Ԫ�أ�![]() ��
��![]() ��
��![]() ��
��![]() ��Ϊͬλ�أ�
��Ϊͬλ�أ�![]() ��
��![]() ������ͬ��ԭ����������
������ͬ��ԭ����������
��2����Cu�ǵ��ʣ��Ǵ�����ܵ��磬�Ȳ��ǵ���ʣ�Ҳ���Ƿǵ���ʣ�
��BaSO4�����Ǵ����Ļ��������״̬���ܵ��磬���ڵĵ���ʣ�
�����ڵ�NaCl�Ǵ����Ļ����ˮ��Һ�л�����״̬���ܵ��磬���ڵĵ���ʣ�
��Fe(OH)3�����ǻ����Ȳ��ǵ���ʣ�Ҳ���Ƿǵ���ʣ�
�ݴ������Ǵ����ˮ��Һ���ܵ��磬���ڵĵ���ʣ�
��CO2�Ǵ�������ڷǵ���ʣ����������̼���ܵ��磻
�������ǵ��ʣ��Ǵ���������磬�Ȳ��ǵ���ʣ�Ҳ���Ƿǵ���ʣ�
��ʯ��ˮ�ǻ����ܵ��磻
�ʴ�Ϊ���ܢࣻ�٣��ڢۢݣ��ޡ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ��480mL0.1molL-1������ͭ��Һ���������Ʒ�����ȷ���ǣ�������
A. ��ȡ![]() ������CuSO4��5H2O�������500mL��Һ
������CuSO4��5H2O�������500mL��Һ
B. ��ȡ![]() ������CuSO4��5H2O��������500mLˮ�����Һ
������CuSO4��5H2O��������500mLˮ�����Һ
C. ��ȡ![]() ��ˮ����ͭ��ĩ������480mLˮ�����Һ
��ˮ����ͭ��ĩ������480mLˮ�����Һ
D. ��ȡ![]() ��ˮ����ͭ��ĩ������500mLˮ�����Һ
��ˮ����ͭ��ĩ������500mLˮ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1��3.01��1023���������ӵ����ʵ�����________________ ��
��2��4g�����Ƶ����ʵ�����________________��
��3��1molH2O������Ϊ________________��
��4��24g O2����������ԭ����Ŀ����NA��ʾ��________________��
��5���ڱ�״���£�33.6L NH3�����ʵ���Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ�Ļ������ף����ܺ�NO��CO2��NO2��NH3��N2�еļ��֣���100mL�����徭����ͼ��ʾʵ��Ĵ���������õ�������Һ��������������ʣ�࣬�����������Ϊ�� ��
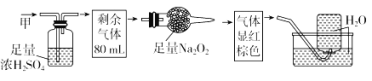
A. NH3��NO2��N2B. NH3��NO��CO2
C. NH3��NO2��CO2D. NO��CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ػ�������ȡһ����ij�������ŷ�ˮ�����ֳɼס��ҡ��������ķݣ�������ͼ��ʾ̽����

��֪��ˮ�����п��ܺ����±��е����ӣ�
������ | Na����Mg2����X |
������ | Cl����SO��Y��NO |
��1������X��________(�ѧʽ����ͬ)������Y��________��
��2�����в���ȷ���Ƿ���ڵ���������________����֤�����������Ƿ���ڵļ�ʵ�����Ϊ______________________________________________
��3������ʵ��������������������Ӧ�����ӷ���ʽ��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ��������������Na2SO4��ˮ��ԭ����ͼ��ʾ�����ö��Ե缫��ab��cd��Ϊ���ӽ���Ĥ����ֱ���糡�������£���Ĥ�м��Na+��SO42����ͨ�����ӽ���Ĥ�������˸��������ӱ��赲���ܽ����м���ҡ�

����������ȷ���ǣ� ��
A. ͨ����м���ҵ�SO42������������Ǩ�ƣ���������ҺpH����
B. �÷��ڴ�����Na2SO4��ˮʱ���Եõ�NaOH��H2SO4��Ʒ
C. ������ӦΪ2H2O 4e�C = O2+4H+����������ҺpH����
D. ����·��ͨ��1mol���ӵĵ���ʱ������0.5mol��O2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����240mL 1.00mol��L��1 Na2CO3��Һ����ش��й����⡣
��1������ʱ������4��������˳���ǣ�����ű�ʾ��ÿ������ֻ����һ�Σ�____��
�ٽ�����ȴ��Na2CO3��Һ�ز�����ע��____�У�
������ƽȷ��ȡ____g Na2CO3���壬������������ˮ��Լ30mL�����ò������������裬ʹ�����ܽ⣻
������ƿ�����ߵ�ҡ�ȣ�
�ܼ���������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�____��������____��ˮ����Һ��Һ����̶������С�
��2���������������Ƶ�Na2CO3��Һ��Ũ��____��ѡ��������������������1.00mol��L-1��������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeBr2��һ�ֻ���ɫ���壬ijѧϰС���Ʊ���̽�����Ļ�ԭ��
��.ʵ�����Ʊ�FeBr2
ʵ��������ͼ��ʾװ����ȡ�廯����������AΪCO2����װ�ã�D��d�о�ʢ��Һ�壬EΪ����¯˿�IJ���ֹܣ�e���������µĴ�������ʢ��ϸ���ۡ�
ʵ�鿪ʼʱ�Ƚ����ۼ�����600�桫700�棬Ȼ���������CO2����ͨ��D�У�E���з�Ӧ��ʼ�����Ͻ�d��Һ�����100�桫120���D�У�������Сʱ��������Ӧ�������ܵ�һ�˳����л���ɫ��Ƭ״�廯������
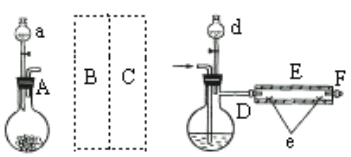
��ش�
(1)����A��ʢ����CaCO3��a��ʢ6mol/L���ᣬB����װ�б���NaHCO3��Һ��ϴ��ƿΪʹ����D�е�CO2Ϊ���﴿�������壬��ͼ��C����װ�ú����е��Լ�Ӧ�ǣ�________,Ϊ��ֹ��Ⱦ������ʵ��ʱӦ��F������ʢ________��β������װ�á�
(2)��Ӧ������Ҫ����ͨ��CO2������Ҫ��������������������CO2�ѷ�Ӧ���п����Ͼ�������________.
��.̽��FeBr2�Ļ�ԭ��
(1)ʵ����Ҫ90 mL 0.1 mol��L��1FeBr2��Һ������FeBr2��Һ���ձ�����Ͳ����ͷ�ιܡ����������IJ���������________��
(2)ȡ10mL����FeBr2��Һ�������еμ��������Ƶ���ˮ������Һ�ʻ�ɫ��ijͬѧ�Բ�����ɫ��ԭ������˼��裺
����1��Br����Cl2������Br2�ܽ�����Һ�У�
����2��Fe2+��Cl2������Fe3+��
���ʵ��֤������2����ȷ��_______________________________
(3)ʵ��֤������ԭ��Fe2+>Br������һ�����ӷ���ʽ��֤����_____________��
(4)����40mL����FeBr2��Һ��ͨ��3��10��3molCl2����Ӧ�����ӷ���ʽΪ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ���ǣ� ��
A.������������Һ����Cl����Ag++Cl����AgCl��
B.��CuSO4��Һ�еμ�Ba(OH)2��Һ��Ba2++SO42����BaSO4��
C.ʵ�����ô���ʯ����ϡ������ȡCO2��CaCO3 + 2H+��Ca2++ CO2��+ H2O
D.�����ܽ���ˮ�У�Cl2+H2O![]() H++Cl��+HClO
H++Cl��+HClO
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com