
【题目】设阿伏加德罗常数为NA,则下列说法正确的是
A.工业合成氨每断裂NA个N≡N键,同时断裂3NA个N-H键,则反应达到平衡
B.常温常压下,16g甲烷所含有的原子数目为NA
C.标准状况下,2.24L戊烷充分燃烧后生成的CO2的体积为11.2 L
D.常温下,CH4发生取代反应生成1molCH2Cl2,至少需要消耗2NA个Cl2分子
【答案】D
【解析】
A.根据N2 + 3H2 ![]() 2NH3,断裂NA个N≡N键同时断裂3NA个N-H键,即消耗1mol N2的同时消耗1mol NH3,说明正、逆反应速率不相等,反应没有达到平衡状态,故A错误;
2NH3,断裂NA个N≡N键同时断裂3NA个N-H键,即消耗1mol N2的同时消耗1mol NH3,说明正、逆反应速率不相等,反应没有达到平衡状态,故A错误;
B.16g甲烷的物质的量为![]() =1mol,1mol甲烷中含有1mol碳原子和4mol氢原子,总共含有5mol原子,所含有的原子数目为5NA,故B错误;
=1mol,1mol甲烷中含有1mol碳原子和4mol氢原子,总共含有5mol原子,所含有的原子数目为5NA,故B错误;
C.在标况下,戊烷不是气体,不能使用标况下的气体摩尔体积计算其物质的量和燃烧后生成的CO2的体积,故C错误;
D.甲烷发生取代反应时可能同时生成CH3Cl、CH2Cl2、CHCl3和CCl4,故当生成1mol二氯甲烷时,可能同时生成了部分CH3Cl、CHCl3和CCl4,消耗的氯气的物质的量至少为2mol,故至少需要2NA个氯气分子,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是
A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA
B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA
D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~N存在如图转化关系,其中气体D、E为单质,试回答:
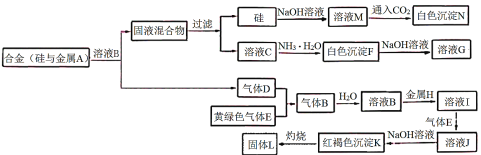
(1)写出下列物质的化学式:
气体B是___,沉淀N是___。
(2)写出反应“C→F”的离子方程式:___。
(3)写出反应“I→J”的离子方程式:___。
(4)在溶液I中直接滴加NaOH溶液,放置中可观察到的现象是___,后期发生变化的原因可用化学方程式解释为___。
(5)固体L是一种红色颜料,将一定量固体L溶于160mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
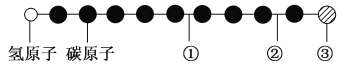
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由C元素形成的单质,已知甲+乙=丁+己,甲+丙=戊+己,0.1mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
A. 原子半径:D>C >B>A
B. B元素只能形成一种二元含氧酸,且B元素的含氧酸对应的酸酐一定是氧化物
C. 1mol甲与足量乙反应转移电子的数目为NA
D. 1.0L 0.1mol·L-1戊溶液中阴离子总的物质的量小于0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在现用周期表中氧族元素包括 ______________________(填元素名称)五种元素,其中Se的基态原子的电子排布式为______________________,元素X与Se同周期,X元素原子核外未成对电子数最多,X为______________________(填元素符号)。
(2)与氧同周期的相邻元素中,第一电离能有大到小的顺序______________________。
(3)臭鼬排放的臭气主要成分为3—MBT(3—甲基—2—丁烯硫醇,结构如图)。1mol3—MBT中含有σ键数目为____________(NA为阿佛加德罗常数的值)。沸点:3—MBT____________(CH3)2C==CHCH2OH(填“>”“<”或“=”),主要原因是________________________。

(4)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法正确的是__________(填序号)。
A.中心原子的价层电子对数不相等
B.都是极性分子
C.中心原子的核对电子数目不相等
D.都含有极性键
②SO3分子的空间构型为__________,与其互为等电子体的阴离子为__________(举一例)。
(5)单质Po是有__________键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏加德罗常数的值为NA,则钋晶体的密度的表达式为____________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内。下列关于萜类化合物a、b的说法正确的是
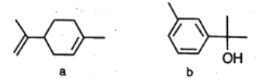
A.a中六元环上的一氯代物共有3种(不考虑立体异构)
B.a分子中所有原子都可能共平面,b的分子式为C10H12O
C.a和b都能发生加成反应、氧化反应、取代反应
D.1 mol b与足量的钠反应产生1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的化学方程式:______________________。
(2)某工程师为了从使用过的腐蚀废液(主要含CuCl2、FeCl3溶液等)中回收铜,并重新获得纯净的FeCl3溶液,准备采用如图所示流程:(已知:加过量①为Fe;加过量④为稀盐酸;通入⑥为Cl2)
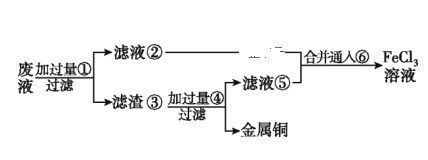
①上述实验中滤渣③的主要物质为___________________(填化学式),写出向②⑤的合并液中通入⑥的离子方程式:______________________________。
②配制并保存FeCl2溶液时,需加入铁屑,其目的是_______________________________。
③要证明FeCl3溶液是否含有Fe2+,可选择下列选项中的______________(已知:加入该物质后,生成蓝色沉淀)。
A.加入 K3[Fe(CN)6]溶液 B.加入NaOH溶液 C.加入KSCN溶液
(3)现有1.2 L含3 mol FeCl2的酸性溶液恰好与0.6 mol HIO3完全反应,还原产物为_______(填化学式,已知该物质遇淀粉溶液变蓝),该反应离子方程式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com