
| A. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| B. | 同温度、同浓度的NaCl溶液和氨水的导电能力 | |
| C. | 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 | |
| D. | 25℃时,pH为3的盐酸和pH为11的Ba(OH)2溶液中水的电离程度 |
分析 A.pH均为2,C〔H+〕=1×10-2mol/L;
B.氯化钠是强电解质完全电离,氨水是弱电解质部分电离;
C.盐酸是强酸完全电离,乙酸是弱酸部分电离;
D.盐酸是强电解质完全电离,三氯化铁是强酸弱碱盐水解.
解答 解:A.根据pH=-lgC〔H+〕公式,pH均为2,H2SO4溶液和盐酸中氢离子的物质的量浓度C〔H+〕=1×10-2mol/L,两者相等,故A错误;
B.同温度、同浓度的NaCl溶液和氨水,氯化钠是强电解质完全电离NaCl=Na++Cl-,电离出的离子浓度等于氯化钠浓度的两倍,而氨水是弱电解质,部分电离,所以电离出的离子小于其浓度的了两倍,离子浓度大导电能力强,所以,导电能力前者比后者大,故B正确;
C.根据pH=-lgC〔H+〕公式,pH均为2,H2SO4溶液和盐酸中氢离子的物质的量浓度C〔H+〕=1×10-2mol/L,盐酸是强酸完全电离,所以,盐酸的物质的量浓度等于1×10-2mol/L,乙酸是弱酸部分电离,它的物质的量的浓度大于1×10-2mol/L,前者小,后者大,故C错误;
D.水的电离方程式:H2O?H++OH-,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离,盐酸是强电解质完全电离,三氯化铁是强酸弱碱盐水解,所以前者抑制水的电离,后者促进水的电离,前者小于后者,故D错误;
故选B.
点评 本题考查了水的电离和强弱电解质的电离,注意pH=-lgC〔H+〕公式与氢离子浓度间的关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写成B与足量NaHCO3溶液完全反应的化学方程式:
;写成B与足量NaHCO3溶液完全反应的化学方程式: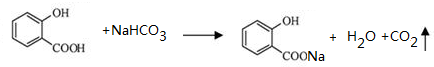 .
. .
. )是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1用于放出碘的四氯化碳溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| C. | 2NO2=O2+2NO△H=+116.2kJ/mol(反应热) | |
| D. | S(s)+O2(g)═SO2(g)△H=-296.8kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 题述反应条件下还原性:CO>Pd | |
| B. | 题述反应中PdCl2被氧化 | |
| C. | 生成22.4 L CO2时,转移的电子为2 mo1 | |
| D. | CO气体只有在高温下才能表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X气体是F3O2,它具有还原性 | |
| B. | X气体是OF2,它具有氧化性 | |
| C. | 在F2与NaOH反应时,F2既是氧化剂又是还原剂 | |
| D. | 在反应中还有NaFO生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,将pH=11的氢氧化钠溶液稀释100倍后,溶液的pH=13 | |
| B. | pH=1的盐酸和醋酸溶液,分别加水稀释100倍后醋酸溶液pH更小 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,醋酸溶液消耗NaOH的物质的量更多 | |
| D. | pH=1的洁厕剂中c(H+)是pH=6的洗发液中c(H+)的105倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com