
| A. | KOH═K++OH- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═2H++SO42- | D. | Fe2(SO4)3═Fe23++3SO42- |
分析 强电解质完全电离,用等号;弱电解质部分电离用可逆号,弱酸的酸式根离子应不能拆,强酸的酸式根离子应拆成离子形式,注意原子团不能拆,据此解答.
解答 解:A.氢氧化钾为强电解质,完全电离,电离方程式:KOH═K++OH-,故A正确;
B.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故B错误;
C.硫酸为强电解质,完全电离,电离方程式:H2SO4═2H++SO42-,故C正确;
D.硫酸铁为强电解质,完全电离,电离方程式:Fe2(SO4)3═2Fe3++3SO42-,故D错误;
故选:AC.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意弱酸的酸式根离子不能拆,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物对应水化物的酸性:Z>X | D. | Y、Z离子均能抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成22.4L氧气转移的电子数为2 NA | |
| B. | 18g D2O中含有的电子数和中子数均为10 NA | |
| C. | 密闭容器中2mol NO与1mol O2充分反应,产物的分子数为2 NA | |
| D. | 1mol Na与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存FeCl2溶液时,通常在溶液中加少量的单质铁 | |
| B. | 常温下,浓硝酸可以用铁罐车贮运 | |
| C. | 可用湿润的蓝色石蕊试纸检验氨气 | |
| D. | 除去CO2中混有的HCl,可通过盛有饱和NaHCO3溶液的洗瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L -1 NaHC2O4溶液与0.1 mol•L -1KOH溶液等体积混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L -1NH4Cl溶液与10mL 0.1 mol•L -1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1 mol•L -1NH3•H2O溶液与0.1 mol•L -1HNO3溶液等体积混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应②中Cu2S只发生了氧化反应 | |
| B. | 反应①中氧化产物只有SO2 | |
| C. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA | |
| D. | 将1molCu2S冶炼成2molCu,需要O21mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 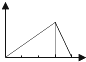 | B. | 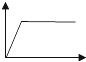 | C. | 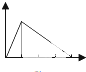 | D. |  | ||||
| E. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com