
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
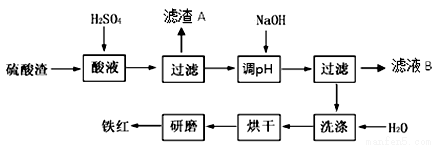
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有Na2SO4、MgSO4和___________;
(4)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
(16分)(1) Al2O3 2分 Fe2O3 + 6H+=2Fe3+ + 3H2O 3分
(2)3.2—3.8 2分 (3) SiO2 3分 Al2(SO4)3 3分 14m/15w 3分
【解析】
试题分析:(1)氧化铝是两性氧化物,则硫酸渣的成分中属于两性氧化物的是Al2O3;氧化铁与硫酸反应生成硫酸铁和水,离子方程式为:Fe2O3 + 6H+=2Fe3+ + 3H2O;
(2)根据几种离子沉淀的pH,使Fe3+沉淀完全的pH为3.2,其他离子开始沉淀pH为3.8,因此所选pH因介于3.2和3.8之间;
(3)因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2;未沉淀的离子为Na+、Mg2+、Al3+,故滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4;
(4)设原来硫酸渣中铁元素质量分数为x,则根据铁元素守恒可知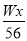 ×0.75=
×0.75=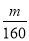 ×2,解得x=
×2,解得x=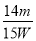 。
。
考点:以铁及其化合物为载体,以流程图形式考查了氧化还原反应知识、元素化合物的知识


科目:高中化学 来源: 题型:
| A、①⑤ | B、①④ | C、②③⑥ | D、①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中有高纯硅单质,光导纤维的主要成分也是硅 | B、分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | C、核磁共振谱、红外光谱、紫外光谱和质谱法的综合运用,可用于分析有机物的结构 | D、绿色荧光蛋白在研究癌症发病机制的过程中应用突出,在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
用右图表示的一些物质或概念间的关系不正确的是
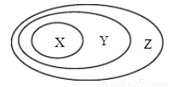
| X | Y | Z |
A. | 酸 | 化合物 | 纯净物 |
B. | 电解质 | 盐 | 化合物 |
C. | 胶体 | 分散系 | 物质 |
D. | 碱性氧化物 | 氧化物 | 化合物 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:实验题
(14分)二氯化锡是一种重要的电镀原料,又称氯化亚锡。分子式为SnCl2,其沸点为623℃,在水溶液中以SnCl2·2H2O的形式析出。锡的另一种氯化物SnCl4的沸点为114℃。某锡花中(主要成分为锡)含有杂质钡、锑、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如下:
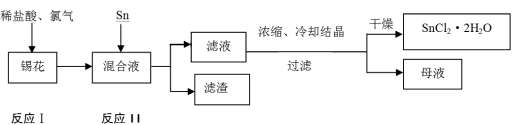
(1)滤渣成分为 (用化学式表示)。
(2)经过氯化后的锡主要以SnCl4的形式存在混合液中。写出锡与SnCl4反应的化学方程式 。
(3)反应Ⅰ进行反应时,加热反应器使反应液温度升高至600C,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80℃~90℃之间,不宜过高。请解释
①温度不宜过高的原因是 ;
②开始通入氯气时,气体流量不宜过大,随反应的进行逐渐加大氯气的通入量,此操作的目的是 。
(4)母液中含有的离子有H+、OH-、 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
A.分别升高温度,两种溶液的pH均减小
B.相同温度下两种溶液的pH:Na2CO3> NaHCO3
C.分别加入少量NaOH,两溶液中c(CO32-)均增大
D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)碘元素的单质和化合物在现实生产生活中应用广泛。
(1)碘化钾(KI)是常用的还原剂。某研究性学习小组利用碘酸钾(KIO3)测定碘化钾的浓度。在10.00mL的KI溶液中逐滴滴入用硫酸酸化的 KIO3溶液,溶液颜色不再变化后,用Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),消耗0.2000mol·L-1 Na2S2O3溶液30.00mL。
滴定过程发生的离子方程式如下:2S2O32-+I2===S4O62-+2I-;
①写出本实验中碘酸钾和碘化钾反应的化学方程式,并标出电子转移的方向和数目:_______________________________________________________。
②滴定终点判断 ;
③测定的KI溶液浓度是 mol·L-1。
(2)探究酸性KIO3溶液的与KI溶液反应中KIO3浓度和温度对反应速率的影响,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
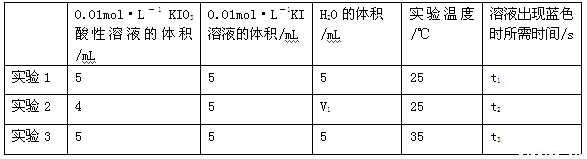
①由小到大比较t1、t2、t3的大小 ;表中V1= mL;
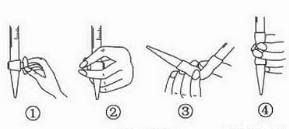
②用Na2S2O3标准溶液滴定生成的I2,滴定前排气泡时,应选用下图中的_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com