
(14分)二氯化锡是一种重要的电镀原料,又称氯化亚锡。分子式为SnCl2,其沸点为623℃,在水溶液中以SnCl2·2H2O的形式析出。锡的另一种氯化物SnCl4的沸点为114℃。某锡花中(主要成分为锡)含有杂质钡、锑、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如下:
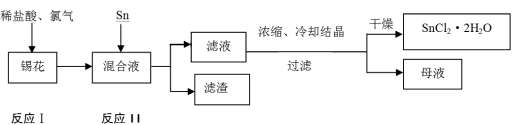
(1)滤渣成分为 (用化学式表示)。
(2)经过氯化后的锡主要以SnCl4的形式存在混合液中。写出锡与SnCl4反应的化学方程式 。
(3)反应Ⅰ进行反应时,加热反应器使反应液温度升高至600C,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80℃~90℃之间,不宜过高。请解释
①温度不宜过高的原因是 ;
②开始通入氯气时,气体流量不宜过大,随反应的进行逐渐加大氯气的通入量,此操作的目的是 。
(4)母液中含有的离子有H+、OH-、 。
(1)Sb、Cu、Sn(3分)
(2)Sn+SnCl4= 2SnCl2(2分)
(3)①因为温度过高,若超过SnCl4的沸点114℃,会造成锡的损失(3分)
②防止因反应开始时,反应液的温度较低,反应速率慢,氯气流量过大造成氯气来不及反应而逸出。(3分)
(4)Ba2+ 、Cl- 、Sn2+ 、(Pb2+)(3分)
【解析】
试题分析:(1)锡花中主要成分为锡,含有杂质钡、锑、铜、铅等金属,加入稀盐酸和氯气溶解并氧化得到的混合液中锡以Sn2+、Sn4+存在,向其中加入Sn粉,金属性比锡强的钡和铅以Ba2+ 、Pb2+ 存在溶液中,而金属性比锡弱的,被置换产生滤渣(Sb、Cu)故滤渣为Sb、Cu和过量的Sn;(2)经过氯化后的锡主要以SnCl4的形式存在混合液中,SnCl4与锡发生归中反应:Sn+SnCl4= 2SnCl2 ;(3)①反应Ⅰ进行反应时,加热反应器使反应液温度升高至600C,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80℃~90℃之间,不宜过高。SnCl4的沸点114℃,若温度过高,会造成锡的损失; ②开始通入氯气时,反应液的温度较低,反应速率慢,气体流量不宜过大,否则会造成氯气来不及反应而逸出,随反应的进行,温度升高,反应速率较快,则可以逐渐加大氯气的通入量;(4)滤液浓缩、冷却结晶、过滤后不以将所有溶质过滤出来,母液中一定含有含有的离子有H+、OH-、Cl- 、Sn2+ 另外,金属性比锡强的钡和铅以Ba2+ 、Pb2+ 一直存在溶液中。
考点:考查制备实验方案的设计,物质分离提纯的方法和基本操作。


科目:高中化学 来源: 题型:
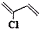 )是制备氯丁橡胶的原料.由于双键上的氢原子很难发生取代反应,因此它不能通过l,3-丁二烯与Cl2直接反应制得.下面是2-氯-1,3-丁二烯的合成路线:
)是制备氯丁橡胶的原料.由于双键上的氢原子很难发生取代反应,因此它不能通过l,3-丁二烯与Cl2直接反应制得.下面是2-氯-1,3-丁二烯的合成路线:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠能与二氧化碳反应,可用作呼吸面具的供氧剂 | B、氧化铝的熔点高,可用于制作耐高温仪器 | C、二氧化硅有导电性,可用于制作光导纤维 | D、石灰石是制水泥和玻璃的主要原料之一 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:实验题
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
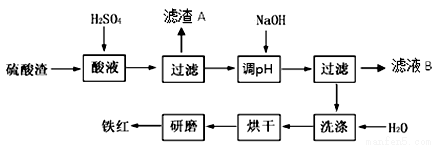
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有Na2SO4、MgSO4和___________;
(4)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+,下列说法不正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强
B.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
C.在H2O2分解过程中,溶液的pH逐渐下降
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
室温下,下列溶液的离子浓度关系正确的是
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
B.NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)
C.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
D.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:填空题
(16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
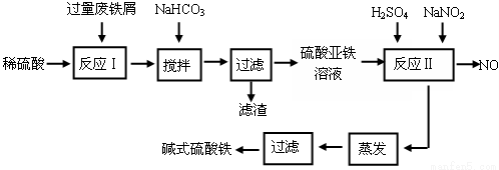
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 ,发生反应的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期主族元素,右图为周期表的一部分。W原子的最外层电子数是其电子层数的2倍。下列说法正确的是
| X |
| Y |
Z |
| W |
|
A.通常情况下,X元素只存在两种氧化物
B.Y元素气态氢化物的还原性最强
C.X元素的非金属性比Y元素非金属性强
D.W的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:实验题
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示:
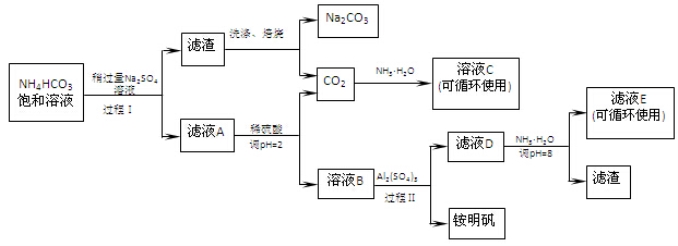
(1)溶液C中的溶质主要是 。
(2)铵明矾的溶液呈 性,铵明矾可用于净水,用离子方程式说明原理 。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是 。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因
(5)滤液E中溶质离子为
(6)写出工艺流程中焙烧的反应方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com