
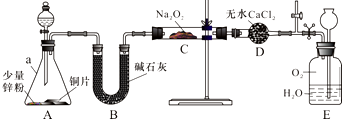
 NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.
NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.分析 装置A中铜片和少量锌粉中从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解生成氢气,利用产生H2来排出装置中的空气,再加入稀硝酸和铜发生氧化还原反应生成一氧化氮气体,通过碱石灰吸收水蒸气和硝酸蒸气,得到干燥纯净的一氧化氮和过氧化钠是否发生反应,装置D是避免E中水蒸气进入C干扰验证结果,剩余气体通入装置E和氧气在水溶液中反应生成硝酸.
(1)仪器a是锥形瓶,D装置是防止水蒸气进入装置C;
(2)稀硫酸和锌反应生成氢气,用来排除装置中的空气,避免干扰实验;
(3)若无B装置A中挥发出的水蒸气和硝酸蒸汽会进入C管与Na2O2反应;
(4)E中气体先变红棕色是一氧化氮和氧气反应生成二氧化氮,最终又变无色是二氧化氮和水反应生成硝酸和一氧化氮,按照一定比例一氧化氮和氧气在水溶液中生成硝酸;
(5)一氧化氮和过氧化钠可能发生反应生成硝酸钠或亚硝酸钠,或二者的混合物;
(6)①亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水,硝酸银易溶于水;
②若a g全部是硝酸钠,则b-c=a,若全部为NaNO3,依据分解的化学方程式计算,假设3成立时b-c的数字范围介于二者之间.
解答 解:(1)根据仪器的特征可知,仪器a的名称是锥形瓶,干燥管D的作用是防止E中的水蒸气进入C管,
故答案为:锥形瓶,防止E中的水蒸气进入C管;
(2)稀硫酸和锌反应生成氢气,用来排除装置中的空气,避免干扰实验,
故答案为:产生H2来排出装置中的空气;
(3)若无B装置,后果是A中挥发出的水蒸气和硝酸蒸汽会进入C管与Na2O2反应,干扰实验,
故答案为:A中挥发出的水蒸气和硝酸蒸汽会进入C管与Na2O2反应,干扰实验;
(4)E中气体先变红棕色是一氧化氮和氧气反应生成二氧化氮,最终又变无色是二氧化氮和水反应生成硝酸和一氧化氮,按照一定比例一氧化氮和氧气在水溶液中生成硝酸,E中发生反应的化学方程式为:4NO+3O2+2H2O═4HNO3,
故答案为:4NO+3O2+2H2O═4HNO3;
(5)提出假设:假设1.白色固体只有NaNO2;假设2.白色固体只有NaNO3,假设3.白色固体是两种物质的混合物,
故答案为:NaNO3;
(6)①亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水,要证明假设2是否成立,实验操作、现象和结论是取C管中的固体少量于试管中溶于水,加入AgNO3溶液,若没有浅黄色沉淀,则假设2成立;若有沉淀则假设2不成立,
故答案为:取C管中的固体少量于试管中溶于水,加入AgNO3溶液,若没有浅黄色沉淀,则假设2成立;若有沉淀则假设2不成立;
②为证明是假设1还是假设3成立,称取C中生成的白色固体a g置于坩埚中(坩埚质量为c g),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为b g,若a g全部是硝酸钠,则b-c=a,若全部为NaNO3,依据分解的化学方程式计算,
2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑
2×85 2×69
ag (b-c)g
b-c=$\frac{69}{85}$a 假设3成立时b-c的数字范围是$\frac{69}{85}$a<b-c<a,
故答案为:$\frac{69}{85}$a<b-c<a.
点评 本题考查了物质性质实验验证、实验基本操作、物质成分分析判断、物质检验等知识点,注意假设的计算判断方法,掌握基础是解题关键,题目难度中等.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中共价键越强,熔点越高 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 氯化钠晶体熔化时离子键发生断裂 | |
| D. | 金属晶体熔化时金属键未发生断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:
用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
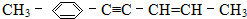 ,共面的碳原子最多有
,共面的碳原子最多有 ;
;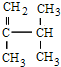 系统法命名的名称为2,3-二甲基-1-丁烯.
系统法命名的名称为2,3-二甲基-1-丁烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
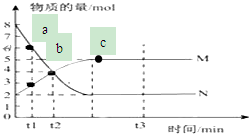 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
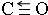 .NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
.NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
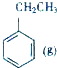 +CO2(g)?
+CO2(g)?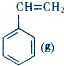 +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H ?
? +H2(g)△H1=+117.6kJ/mol
+H2(g)△H1=+117.6kJ/mol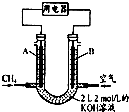
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com