
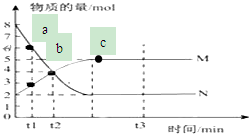
 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:分析 (1)化学方程式的系数之比等于各物质的物质的量的变化量之比;
(2)根据v=$\frac{\frac{△n}{V}}{△t}$计算v(M);
(3)由图可知,ab点还在向正反应方向进行;
(4)当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断.
解答 解:(1)参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,所以此反应的化学方程式中$\frac{a}{b}$=2:1,故答案为:2:1;
(2)由图可知,t1到t2时刻M的物质的量变化为4mol-3mol=1mol,故v(M)=$\frac{\frac{1mol}{VL}}{(t2-t1)min}$=$\frac{1}{(t1-t2)×v}$mol/(L•min),故答案为:$\frac{1}{(t1-t2)×v}$mol/(L•min);
(3)由图可知,ab点还在向正反应方向进行,正反应速率大于逆反应速率,故答案为:ab;
(4)A.平衡时反应混合物各组分的物质的量不变,但各组分的物质的量不一定相等,故A错误;
B.混合气体的总质量始终不变,混合气体总质量不变不能说明到达平衡,故B错误;
C.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,故C正确;
D.单位时间内消耗amolN,同时生成bmolM,都表示正反应速率,反应始终按此关系进行,不能说明到达平衡,故D错误;
故答案为:C.
点评 本题考查化学反应速率计算、化学平衡计算、化学平衡状态判断,难度不大,侧重对基础知识的巩固,注意判断化学平衡状态的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


科目:高中化学 来源: 题型:选择题
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池中电极b是正极 | |
| B. | 外电路中电子由电极b通过导线流向电极a | |
| C. | 该电池的正极反应为O2+4H++4e-=2H2O | |
| D. | 该电池的总反应:2H2+O2=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
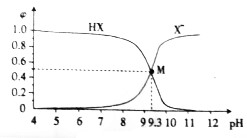
| A. | 25℃时,$\frac{c(HX)}{c({X}^{-})•c({H}^{+})}$=109.3 | |
| B. | M点溶液中存在:c(X-)+c(OH-)=c(H+)+c(Na+) | |
| C. | 滴加盐酸的过程中,水的电离程度先减小后增大 | |
| D. | 常温下,等浓度等体积的HX和NaX溶液混合后,溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
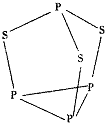 三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
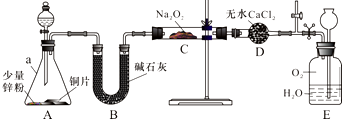 NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.
NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
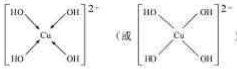 (不考虑空间构型).
(不考虑空间构型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向相同体积,相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积,可以比较两种一元酸的酸性相对较弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至恰好不再有沉淀生成,再向其中滴加Na2S溶液,生成黑色沉淀,说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH,可以比较HClO和CH3COOH的酸性强弱 | |
| D. | 在滴有酚酞Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
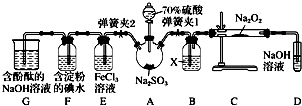
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | … | |
| R | 740 | 1500 | 7700 | 10500 | 13600 | … |
| A. | ①③ | B. | ②③ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com