
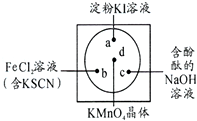
 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.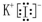 ,故答案为:5;
,故答案为:5;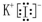 ;
;

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| A、加入NaOH固体 |
| B、加入NaCl固体 |
| C、加入CH3COOH固体 |
| D、升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
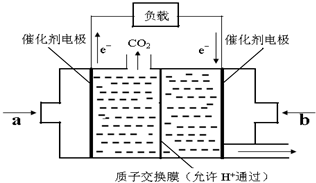 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.查看答案和解析>>
科目:高中化学 来源: 题型:
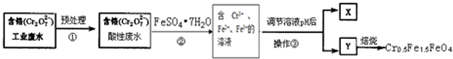
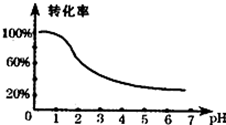
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
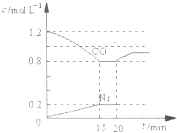 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);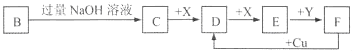
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl,KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液X中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 |
| C、常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 |
| D、常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com