
| A、0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 |
| C、常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 |
| D、常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9 |
| 1 |
| 100 |
| 1 |
| 100 |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
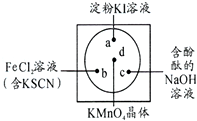 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.查看答案和解析>>
科目:高中化学 来源: 题型:
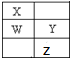 W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、常压下四种元素的单质中,X的非金属性最强 |
| B、四种元素都能与氧元素形成稳定的化合物 |
| C、Y、Z 离子最外层电子数相同 |
| D、Y元素具有两性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 实验 方案 |  | 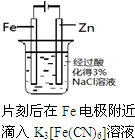 |  | 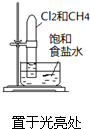 |
| 实验 目的 | 验证铁钉发生了 析氢腐蚀 | 验证Fe电极被保护 | 验证乙烯的产生 | 验证甲烷与氯气发生了化学反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B、1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C、溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D、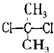 与 与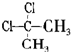 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com