
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
| m |
| M |
| m |
| M |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
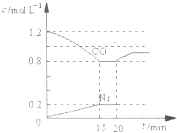 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);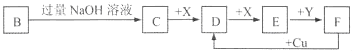
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、原子半径:Z>Y>X |
| B、R元素的含氧酸和W元素的含氧酸,酸性一定前者强 |
| C、X和Z形成的化合物能溶于NaOH溶液 |
| D、Y和W形成的化合物中,阴阳离子的个数可能比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 |
| C、常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 |
| D、常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B、100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| C、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| D、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol的K+ |
| B、0.5 mol的H+ |
| C、1.0 mol的H+ |
| D、1.0 mol的OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com