
| A、1g H2 |
| B、10g O2 |
| C、30gCl2 |
| D、17g NH3 |
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
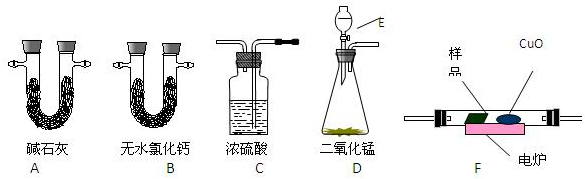
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 |
B、与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
| C、含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 实验 方案 |  | 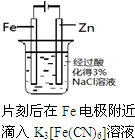 |  | 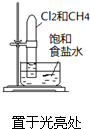 |
| 实验 目的 | 验证铁钉发生了 析氢腐蚀 | 验证Fe电极被保护 | 验证乙烯的产生 | 验证甲烷与氯气发生了化学反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、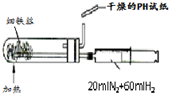 合成氨并检验氨的生成 |
B、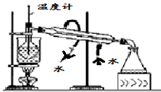 碘的CCl4溶液中分离I2并回收CCl4 |
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com