
 100mL CaCl2和HCl的混合溶液中加入Na2CO3溶液时,测得生成的沉淀(纵)和所加入Na2CO3溶液的体积(横)的曲线如图所示,若CaCl2的浓度为0.2mol/L,计算原溶液中盐酸的物质的量浓度.
100mL CaCl2和HCl的混合溶液中加入Na2CO3溶液时,测得生成的沉淀(纵)和所加入Na2CO3溶液的体积(横)的曲线如图所示,若CaCl2的浓度为0.2mol/L,计算原溶液中盐酸的物质的量浓度.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、NaHCO3溶液与盐酸反应:H++HCO3-═H2O+CO2↑ |
| C、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| D、Fe2+和Cl2的反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
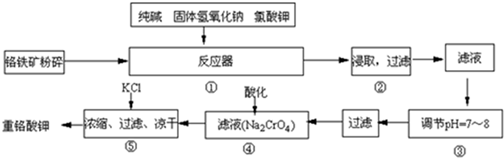
Ⅲ x |
Ⅲ (2-x) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com