
����Ŀ����FeO��Cu(NO3)2�Ļ����9.08gȫ������300mL��1mol/L�������У��в���Fe2+�����������µ�NO3-�������仯ѧ��Ӧ����ʽΪ��3Fe2+��NO3-��4H+��3Fe3+��NO����2H2O�����ų�NO����448mL����״��������������Һ��ͨ��һ������Cl2ǡ�ý���Һ�е�Fe2����ȫ�������ټ���10g���������ۣ���ַ�Ӧ�ų�H2�����ˣ��õ����ܹ��塣������������ȷ����
A��Cu(NO3)2�����ʵ���Ϊ0.01mol
B��ͨ��Cl2���������״����Ϊ448mL
C���ų�H2���������״����Ϊ112mL
D���õ����ܹ��������Ϊ6.72g
���𰸡�C
��������
�������������������ᷴӦ�����Һ��ͨ��һ����������ʱ����Һ�е�Fe2+�պñ���ȫ������������Һ�м���10g���������ۣ���ַ�Ӧ�������������˵������������ᷴӦʱ���������ȫ��Ӧ����������ʣ�࣬A��NO�����ʵ���=![]() =0.02mol�����ݵ�Ԫ���غ㣬��֪����ͭ���ʵ���=
=0.02mol�����ݵ�Ԫ���غ㣬��֪����ͭ���ʵ���= ![]() =0.01mol����A��ȷ��B��NO�����ʵ���=
=0.01mol����A��ȷ��B��NO�����ʵ���=![]() =0.02mol�����ݵ�Ԫ���غ㣬��֪����ͭ���ʵ���=
=0.02mol�����ݵ�Ԫ���غ㣬��֪����ͭ���ʵ���= ![]() =0.01mol��������ͭ����=0.01mol��188g/mol=1.88g������������������=9.08-1.88g=7.2g���������������ʵ���=
=0.01mol��������ͭ����=0.01mol��188g/mol=1.88g������������������=9.08-1.88g=7.2g���������������ʵ���=![]() =0.1mol����ͨ������Ϊx mol�����ݵ���ת���غ㣺0.1��1=0.02����5-2��+2x�����x=0.02mol����ͨ�����������Ϊ0.02mol��22.4L/mol=0.448L=448mL����B��ȷ��C������NO�����ʵ���Ϊ0.02mol�����ݷ���ʽ3FeCl2+HNO3+3HCl�T3FeCl3+NO��+2H2O����֪����HCl�����ʵ���=0.02mol����3+1��=0.08mol����FeO+2HCl=FeCl2+H2O��֪����HClΪ0.1mol��2=0.2mol���ʹ�����HClΪ0.28mol��ʣ��HClΪ0.3mol-0.28mol=0.02mol��������ԭ���غ㣬�������������ʵ���=
=0.1mol����ͨ������Ϊx mol�����ݵ���ת���غ㣺0.1��1=0.02����5-2��+2x�����x=0.02mol����ͨ�����������Ϊ0.02mol��22.4L/mol=0.448L=448mL����B��ȷ��C������NO�����ʵ���Ϊ0.02mol�����ݷ���ʽ3FeCl2+HNO3+3HCl�T3FeCl3+NO��+2H2O����֪����HCl�����ʵ���=0.02mol����3+1��=0.08mol����FeO+2HCl=FeCl2+H2O��֪����HClΪ0.1mol��2=0.2mol���ʹ�����HClΪ0.28mol��ʣ��HClΪ0.3mol-0.28mol=0.02mol��������ԭ���غ㣬�������������ʵ���=![]() =0.01mol�����������������=0.01mol��22.4L/mol=0.224L=224mL����C������D����FeԪ���غ��֪����Һ��Fe3+Ϊ0.1mol����Fe+2Fe3+=3Fe2+��֪������FeΪ
=0.01mol�����������������=0.01mol��22.4L/mol=0.224L=224mL����C������D����FeԪ���غ��֪����Һ��Fe3+Ϊ0.1mol����Fe+2Fe3+=3Fe2+��֪������FeΪ![]() =0.05mol����Һ��Cu2+Ϊ0.01mol����Fe+Cu2+=Cu+Fe2+��֪������FeΪ0.01mol����������Ϊ0.01mol����Fe+2H+=Fe2++H2������֪����FeΪ0.01mol�����ܹ�����Fe������=��0.05+0.01+0.01��mol��56g/mol=3.92g��ʣ��Fe������=10g-3.92g=6.08g������ܹ���ΪCu��ʣ��Fe������֮�ͣ��ʲ��ܹ�������=6.08g+0.01mol��64g/mol=6.72g����D��ȷ����ѡC��
=0.05mol����Һ��Cu2+Ϊ0.01mol����Fe+Cu2+=Cu+Fe2+��֪������FeΪ0.01mol����������Ϊ0.01mol����Fe+2H+=Fe2++H2������֪����FeΪ0.01mol�����ܹ�����Fe������=��0.05+0.01+0.01��mol��56g/mol=3.92g��ʣ��Fe������=10g-3.92g=6.08g������ܹ���ΪCu��ʣ��Fe������֮�ͣ��ʲ��ܹ�������=6.08g+0.01mol��64g/mol=6.72g����D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���з�����Ӧ�����ӷ���ʽΪ��Zn��2H��=Zn2����H2��������˵���������
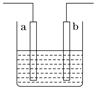
A. a��b��������ͬ�ֲ��ϵĵ缫
B. ��װ�ÿ����ǵ��أ��������ҺΪϡ����
C. ��װ�ÿ�����ԭ��أ��������ҺΪϡ����
D. ��װ�ÿɿ�����ͭ��пԭ��أ��������Һ��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����H2S����Դ�����ú�ɻ����������õ���.����Ӧԭ��Ϊ��2H2S(g)+O2(g)=S2(s)+2H2O(l)��H=-632kJ��mol-1��H2Sȼ�ϵ�صĹ���ԭ����ͼ��ʾ�������й�˵������ȷ������ ��

A. �缫aΪ��صĸ���
B. �缫b�ϵĵ缫��ӦʽΪ��O2+4H++4e-=2H2O
C. ����17gH2S���뷴Ӧ�������1molH+������Ĥ����������
D. ����·��ͨ��2mol���ӣ������ڲ��ͷ�632kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�������ϣ���ѧ�����ȶ��������Ըߣ��������õ����ԡ������ԺͶ������ߵ������ԣ���ij�ֹ�ҵ���Է�Һ����Ҫ��Na����Fe2����Fe3����Mg2����Al3����Cl����![]() ���л���������������ͼ��ʾ��
���л���������������ͼ��ʾ��

��֪��������Ksp[Mg(OH)2]��1.2��10��11��Ksp[Fe(OH)2]��2.2��10��16��Ksp[Fe(OH)3]��3.5��10��38��Ksp[Al(OH)3]��1.0��10��33
��1��д���ڸ����Է�Һ��ͨ�����ʱ������Ӧ�����ӷ���ʽ�� _________��ָ��ʹ�ÿ�����ʹ�������õ�ԭ����__________��
��2����֪Fe3��(aq)��3OH��(aq)=Fe(OH)3(s)����H����Q1 kJ��mol��1���⣨1����ÿ����1 mol������ʱ������Q2���������1 mol Fe2��ȫ��ת��ΪFe(OH)3(s)����ЧӦ��H��________��
��3�������£�������֪����������pH��5����Һ�У�������Fe3���ڸ���Һ�пɴ��ڵ����Ũ��c(Fe3��)��____________��
��4�������ð�ˮ������ҺpH����pH��5ʱ��Fe(OH)3������������ʱ���ܻ��е�������________���ѧʽ����ͬ������________�Լ��ɽ����ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ģ�ҵ��ⱥ��ʳ��ˮ��װ��ͼ������������ȷ����
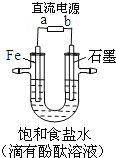
A.a Ϊ��Դ������
B.ͨ��һ��ʱ���ʯī�缫������Һ�ȱ��
C.Fe�缫�ĵ缫��Ӧ��4OH-- 4e��=2H2O��O2��
D.��ⱥ��ʳ��ˮ���ܷ�Ӧ�ǣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�������ϩ�ۺϴ�������Ҫ�ɷ֣��Ʊ���Ӧ���£�
��TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)��H1=+175.4kJ��mol��1
��C(s)+![]() O2(g)=CO(g)��H2=��110.45kJ��mol��1
O2(g)=CO(g)��H2=��110.45kJ��mol��1
����˵����ȷ����
A.C��ȼ�����ǣ�110.45kJ��mol-1
B.����Ӧ����ʹ�ô����ӿ췴Ӧ���ʣ���λʱ�������ո�������������H1���
C.��Ӧ���е������仯��ͼ��ʾ
D.��ӦTiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)��H=��45.5kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PCl3��PCl5������Ҫ�Ļ���ԭ�ϡ���PCl3(g)��Cl2(g)������������2L�ܱ������У���һ�������·�����Ӧ��PCl3(g)��Cl2(g)![]() PCl5(g)������10minʱ�ﵽƽ�⡣�й��������£�
PCl5(g)������10minʱ�ﵽƽ�⡣�й��������£�
PCl3(g) | Cl2(g) | PCl5(g) | |
��ʼŨ��(mol��L��1) | 2.0 | 1.0 | 0 |
ƽ��Ũ��(mol��L��1) | c1 | c2 | 0.4 |
�����жϲ���ȷ����
A.10min�ڣ�v(Cl2)��0.04mol��L��1��min��1
B.��������Cl2Ϊ1.2molʱ����Ӧ�ﵽƽ��
C.�����¶�(T1��T2)����Ӧ��ƽ�ⳣ����С��ƽ��ʱPCl3��![]() ��1
��1
D.ƽ�������2.0molPCl3��1.0molCl2����ͬ�������ٴ�ƽ�⣬c(PCl5)��0.2mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�Ļ���ԭ�ϣ���������ˮâ����Na2SO4����̿�ۻ�ԭ���Ʊ���ԭ��ΪNa2SO4��2C![]() Na2S��2CO2��������Ҫ�������£�
Na2S��2CO2��������Ҫ�������£�

��1�� Na2S��Һ�Լ��ԣ�д����ط�Ӧ�ķ���ʽ����Ҫ��______�����������в���ϡ��Һ������ˮ���ã�������___________��
��2�������£�������������ʵ���Ũ�ȵ�NaHS��Һ��Na2S��Һ��ϣ������Һ��c(S2��)_____c(HS��) ����������������С�������������������������Һ��pH=10����c(HS��)��3c(H2S)��c(S2��)= ___________________
��3����֪��I2��2S2O32-=2I����S4O62-���������Ƶõ�Na2S��9H2O�����к���Na2S2O3��5H2O�����ʡ�Ϊ�ⶨ��Ʒ�ijɷ֣���������ʵ�飬�������£�
a. ȡ����10.00 g���500.00 mL��Һ��
b. ȡ������Һ25.00 mL�ڵ���ƿ�У��������ZnCO3����Һ��ȥNa2S���ˣ�����Һ�е���2��3�ε�����Һ����0.050 00 mol��L��1I2��Һ�ζ����յ㣬��ȥ5.00mL I2��Һ��
c. ��ȡ������Һ25.00 mL�ڵ���ƿ�У�����50.00 mL 0.050 00 mol��L��1��I2��Һ��������2��3�ε�����Һ�����ñ�Na2S2O3��Һ�ζ������I2����ȥ15.00 mL 0.100 0 mol��L��1 Na2S2O3��Һ��
������b����ZnCO3��ȥNa2S�����ӷ���ʽΪ________��
���жϲ���c�еζ��յ�ķ���Ϊ______________��
������������Na2S��9H2O��Na2S2O3��5H2O����������_________��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Ľṹ����������ʽ����ʾ���磺CH3CH=CHCH3�ɼ�дΪ![]() ���л���X�ļ���ʽΪ
���л���X�ļ���ʽΪ![]() ������˵������ȷ���ǣ� ��
������˵������ȷ���ǣ� ��
A.X�Ļ�ѧʽΪC8H10
B.�л���Y��X��ͬ���칹�壬�����ڷ���������Y�Ľṹ��ʽΪ![]()
C.X��ʹ���Ը��������Һ��ɫ
D.X��������H2��һ�������·�Ӧ�����ɻ�״�ı�����Z��Z��һ�ȴ�����2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com