
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,根据判断出的元素回答问题:
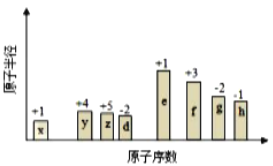
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式____________________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图所示:
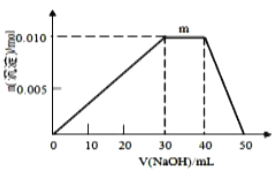
①R中存在的化学键有________________。
②写出m点反应的而离子方程式________________________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后产生沉淀的物质的量为_______mol。
【答案】第三周期ⅢA族 r(O2-) r(Na+) HClO4 H2SO4 ![]() 离子键 共价键 NH4+ + OH-=NH3·H2O 0.022
离子键 共价键 NH4+ + OH-=NH3·H2O 0.022
【解析】
x的原子序数最小,原子半径也最小,且最高正化合价为+1价,则X是H,e的最高正化合价为+1价,原子半径最大,则e是Na,y的原子序数比e小,最高正价为+4价,则y是C,z的原子序数略大于y,最高正化合价为+5价,则z是N,d是O,f原子序数比钠大,最高正化合价为+3价,则f是Al,g的最低负化合价为-2价,原子序数比铝大,则g是S,h最低负价为-1价,原子序数大于硫,则h是Cl,由此分析解答。
从图中的化合价、原子半径的大小及原子序数,可以知道x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,则
(1)f是Al元素,原子核外有3个电子层,最外层电子数为3,在元素周期表的位置是第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4;
(3)x与z形成四原子共价化合物为NH3,电子式为![]() ;
;
(4)①R是NH4Al(SO4)2,其中存在离子键和共价键。
②m点处,沉淀的物质的量不变,发生反应为:铵根离子和氢氧根离子反应成一水合氨,其离子方程式为NH4++OH-=NH3·H2O。
③20mL1.2 mol·L-1Ba(OH)2溶液含有0.048molOH-和0.024molBa2+,10mL1mol·L-1R溶液中含有0.01molNH4+、0.01molAl3+和0.02molSO42-。根据NH4++OH-=NH3·H2O、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O、Ba2++SO42-=BaSO4↓可知当0.048molOH-完全反应完时,还有0.002molAl(OH)3未溶解,0.02molSO42-与钡离子反应生成0.02mol硫酸钡沉淀,所以最后沉淀的物质的量为0.022mol。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
B. 淀粉、纤维素和油脂都属于天然高分子化合物
C. 油脂、淀粉、蔗糖和葡萄糖在一定条件下都能发生水解反应
D. 肌醇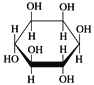 与葡萄糖
与葡萄糖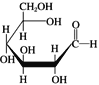 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此均属于糖类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种合成高血压药物的中间体,其合成路线流程图如下:
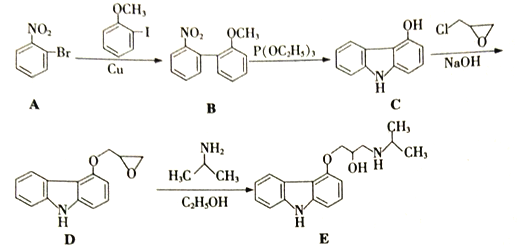
(1)  中所含官能团名称为_____和______。
中所含官能团名称为_____和______。
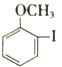
(2)苯环上的硝基对新引入基团的位置会产生一定的影响,如:
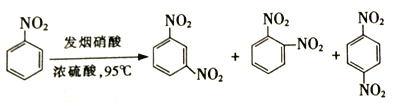 (产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为_________。
(产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为_________。
(3)写出同时满足下列条件的B的一种同分异构体X的结构简式: _________。
①含有两个苯环,分子中有6种不同化学环境的氢;
②既能与盐酸反应,又能与NaHCO3溶液反应。
(4)合成E时,还可能生成一种与E互为同分异构体的副产物Y,Y的结构简式为______。
(5)常温下,苯酚在Br2的CCl4溶液中发生取代反应,得到一溴代物。请写出以苯酚、CCl4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有碳原子可能共平面 B. 除苯环外的碳原子共直线
C. 最多只有4个碳原子共平面 D. 最多只有3个碳原子共直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
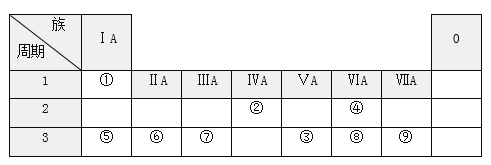
请按要求回答下列问题:
(1)元素⑦的原子结构示意图______________________。①、④按原子个数比为1:1组成的分子的电子式____________________;由②、④两种元素组成的一种化合物的结构式________________;
(2)⑤⑥两种元素的原子半径由大到小的顺序是____________(填元素符号)。
(3)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较弱的是________(填化学式)。
(4)元素③的气态氢化物和元素⑧的气态氢化物易于制备的是___________(填化学式)。
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应水化物反应,其离子方程式为_________________________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式__________________ ;一种离子化合物的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2016年,我国研制的大型运输机运-20正式进入投产,标志着我国成为少数几个能生产大型军用运输机的国家之一。
(1)运-20的外壳大量使用了AM系列Mg-Al-Mn,铝的价电子排布图为_____,第一电离能铝___________(填“大于”、“等于”或“小于”)镁
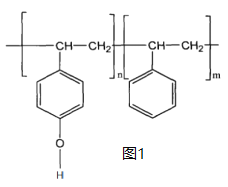
(2)为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为___________,其个数比为___________
II.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料
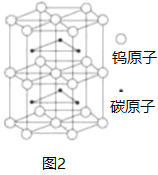
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式___________
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为___________,其中一个钨原子周围距离最近且相等的碳原子有___________个。下列金属的堆积方式与晶胞中钨原子堆积方式完全相同的是___________
A.Fe Cu B.Ti Ag C.Cu Au D.Zn Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙烯、乙醛(C2H4O)组成的混合物中,氢元素的质量分数是9%,则氧元素的质量分数为()
A. 16% B. 37% C. 48% D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体,所含化学键类型相同,晶体类型也相同的是( )
A.C(金刚石)和CO2B.CCl4和KClC.CH4和H2OD.NaCl和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种烃,已知:
①B完全燃烧的产物n(CO2)∶n(H2O)=2∶3。
②C为饱和链烃,通常状况下呈气态,其二氯代物有三种。
③A是B分子中的氢原子全部被C分子中的最简单的烃基取代的产物;A遇Br2的CCl4溶液不褪色,其一氯代物只有一种。
试回答下列问题:
(1)B的最简式为________,分子式为________,其二溴代物有________种。
(2)C的三种二氯代物的结构简式分别为____________、________、________。
(3)A的结构简式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com