
利用海洋资源获得的部分物质如下图所示,有关说法正确的是
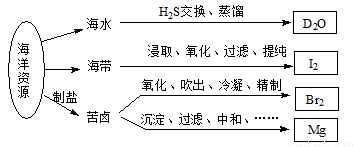
A.在化学反应中,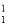 H2O可转变为D2O
H2O可转变为D2O
B.“加碘食盐”生产中碘添加剂为单质I2
C.实验室用带玻璃塞的棕色瓶贮存液Br2
D.电解饱和MgCl2溶液时在阴极得到Mg
科目:高中化学 来源:2015-2016学年辽宁省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列叙述正确的是:
A、铜、铁和FeCl3溶液形成的原电池,铜极放出氢气
B、电解硫酸钠溶液就是电解水,电解后溶液pH升高
C、铁锅生锈的正极反应为:O2+2H2O+4e-===4OH-
D、工业上电解饱和食盐水的阳极反应为:2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高三上学期期中测试化学试卷(解析版) 题型:填空题
过氧化氢常用作氧化剂、漂白剂和消毒剂,可用于甲型H1N1流感消毒,为了贮存运输和使用的方便,工业上采用“醇析法”,将它转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和Na2O2的双重性质,工业“醇析法”的工艺如下:
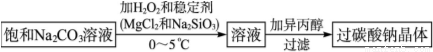
注:反应温度控制在0~5 ℃时进行在低温下H2O2与2Na2CO3·3H2O2稳定(不易分解)且2Na2CO3·3H2O2的溶解度小
回答下列问题:
(1)过氧化氢溶液加入二氧化锰的反应化学方程式为___________________。
(2)稳定剂能相互反应,生成一种不溶物将过碳酸钠粒子包住,该反应的化学方程式为 ___。
(3)加入异丙醇的作用是________________。
(4)下列物质不能使过碳酸钠较快失效的是_______ _。
a.FeCl2 b.Na2S c.CH3COOH d.NaHCO3
(5)根据题中有关信息,请你提出贮存、运输过碳酸钠晶体中应注意(至少两项):__________________。
(6)某同学向酸性高锰酸钾溶液中滴入过量过氧化氢溶液,观察到高锰酸钾溶液褪色,则发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期11月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.碳酸氢钠溶液中加入盐酸 CO32- + 2H+ =CO2↑ + H2O
B.硫化亚铁与盐酸反应 S2- + 2H+ = H2S↑
C.苯酚钠溶于醋酸溶液 C6H5O- + CH3COOH → C6H5OH + CH3COO-
D.氯化亚铁溶液中通入少量氯气 Fe2+ + Cl2 = Fe3+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:选择题
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是
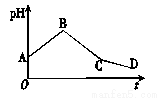
A. A点pH小于7是因为Cu2+水解使溶液显酸性
B. 整个过程中阳极先产生Cl2,后产生O2
C. BC段阳极产物是Cl2
D. CD段电解的物质是水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上一次月考化学试卷(解析版) 题型:选择题
下列溶液一定是碱性的是
A.pH=8的某电解质的溶液 B.c(OH-)>1×10-7mol/L
C.溶液中含有OH- D.溶液中c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:实验题
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
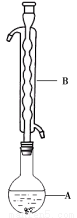
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是____________。其作用是__________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.00 | 30.82 |
第二次 | 0.00 | 30.80 |
第三次 | 0.00 | 30.78 |
列式并计算所得产品的纯度 ,
你认为影响纯度测定的主要原因是(不考虑操作引起误差) 。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期10月月考化学试卷(解析版) 题型:实验题
(12分)资源综合利用既符合绿色化学理念,也是经济可持续发展的有效途径。一种难溶的废弃矿渣杂卤石,其主要成分可表示为: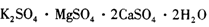 ,已知它在水溶液中存在如下平衡:
,已知它在水溶液中存在如下平衡:

为了充分利用钾资源,一种溶浸杂卤石制备K2S04工艺流程如下:
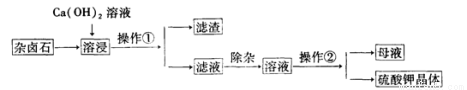
(1)操作①名称是
(2)用化学平衡移动原理解释:Ca(OH)2溶液能溶解出杂卤石中K十的原因:
(3)除杂质环节,为了除去Ca2+,可先加人 溶液,经搅拌等操作后,过滤,再向滤液中滴加稀H2 S04,调节溶液pH至 ;(填“酸性”、“中性”或“碱性”)
(4)操作②的步骤包括(填操作过程):、 、过滤、洗涤、干燥;
(5)有人用可溶性碳酸盐为溶浸剂,其浸溶原理可表示为:

则常温下该反应的平衡常数K=
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com