
【题目】化学反应的本质是旧的化学断裂新的化学键形成,即有新物质的生成,下列变化属于物理变化的是
A.石油的分馏B.煤的干馏
C.氧气变臭氧D.乙烯通入溴水,溴水褪色
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( ) 
A.该反应属于氧化还原反应
B.甲和丙中同种元素化合价不可能相等
C.丁物质一定是非金属单质
D.配平后甲、乙、丙的化学计量数均为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2 , 且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题: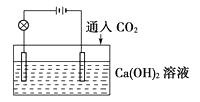
(1)通入CO2前,灯泡(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度。
(3)继续通入过量的CO2 , 灯泡的亮度。
(4)下列四个图中,(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。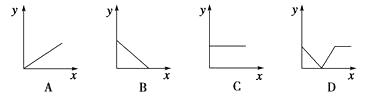
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有下列四种溶液:
① | ② | ③ | ④ | |
溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1molL﹣1的醋酸 | 0.1molL﹣1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10﹣5 . 请回答下列问题:
(1)用④的标准液滴定③宜选用(填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 .
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是(用序号表示),用pH试纸测定溶液pH的操作方法是 .
(3)都是0.1mol/L的①NH4Cl、②NH4HCO3、③CH3COONH4、④NH4HSO4的溶液中NH4+离子浓度大小顺序为 . (用序号填写)
(4)取适量溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为 . 若b点时消耗③的体积为V mL,则V20(填“>”、“<”或“=”). 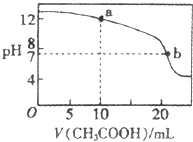
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质正确的是( )
A.分子中所有原子在同一平面上B.与HCl加成只生成一种产物
C.能使KMnO4酸性溶液褪色D.能与溴水发生取代反应而使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: 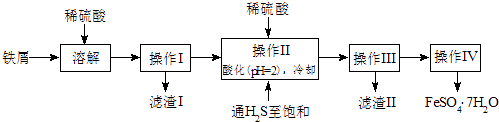
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)操作II中,通入硫化氢至饱和的目的是;在溶液中用硫酸酸化至pH=2的目的是 .
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质,② .
(3)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL. ①滴定时发生反应的离子方程式为: .
②滴定时盛放KMnO4溶液的仪器为(填仪器名称).判断此滴定实验达到终点的方法是
③计算上述样品中FeSO47H2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的液态火箭燃料,具有弱碱性和强还原性.工业上利用尿素[CO(NH2)2]、NaC1O在NaOH溶液中发生反应生成水合肼(N2H4H2O)、Na2CO3等产物.请回答:
(1)上述生成水合肼的反应中尿素是( 填“氧化剂”或“还原剂”),反应的化学方程式为 .
(2)肼与盐酸反应可生成N2H6C12 , N2H6C12的水溶液显性( 填“酸”或“碱”或“中”),用离子方程式表示其原因 .
(3)查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜.取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在高温下恰好完全反应生成氮气等产物,写出该反应的化学方程式 .
若要设计实验方案检验上述反应生成固体产物中的金属离子,补充完整下列实验步骤:
①所得固体溶入浓盐酸中;
②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com