
����Ŀ���̷���FeSO47H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֣���������������м�����������������������ʣ�Ϊԭ�����������̷���һ�ַ����� 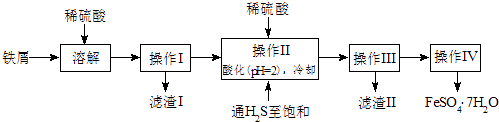
��֪�������±���H2S��Һ��pHԼΪ3.9��SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5��
��1������II�У�ͨ�����������͵�Ŀ����������Һ���������ữ��pH=2��Ŀ���� ��
��2������IV�õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ��ٳ�ȥ������渽�ŵ���������ʣ��� ��
��3���ⶨ�̷���Ʒ��Fe2+�����ķ����ǣ�a����ȡ2.8500g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b����ȡ25.00mL������Һ����ƿ�У�c���������ữ��0.01000mol/LKMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL�� �ٵζ�ʱ������Ӧ�����ӷ���ʽΪ�� ��
�ڵζ�ʱʢ��KMnO4��Һ������Ϊ�����������ƣ����жϴ˵ζ�ʵ��ﵽ�յ�ķ�����
�ۼ���������Ʒ��FeSO47H2O����������Ϊ ��
���𰸡�
��1����ȥ��Һ�е�Sn2+���ӣ�����ֹFe2+����������ֹFe2+�������ɳ���
��2������ϴ�ӹ�����FeSO4?7H2O�����
��3��MnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O����ʽ�ζ��ܣ��μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ��97.54%
���������⣺��м����ϡ�����������������������������˺�õ���Һ������Һ����ϡ�����ữ����ͨ�����⣬������SnS��������ֹ�������ӱ����������˺�õ���ҺΪ����������������Ũ���ᡢ��ȴ�ᾧ�����˿ɵõ�FeSO47H2O����1��ͨ�����������͵�Ŀ���ǣ��������ǿ��ԭ�ԣ����Է�ֹ�������ӱ���������֪����H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5������������Һ���������ữ��pH=2��Ŀ���ǣ�����ҺPH=2ʱ��Sn2+��ȫ�������������Ӳ����������Դ��ǣ���ȥ��Һ�е�Sn2+���ӣ�����ֹFe2+����������ֹFe2+�������ɳ�������2����ˮ�¶ȵͣ������ܽ�ȼ�С������ϴȥ����������������ӣ������̷��ܽ��������ʧ�����Դ��ǣ�����ϴ�ӹ�����FeSO47H2O����ģ���3��������KMnO4��FeSO4��ԭʱ����Mn2+ �� ��Ӧ�����ӷ���ʽΪMnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O�����Դ��ǣ�MnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O���ڸ��������ǿ�����ԣ����Եζ�ʱʢ��KMnO4��ҺҪ����ʽ�ζ��ܣ��ζ�ʵ��ﵽ�յ�ʱ���μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ�����Դ��ǣ���ʽ�ζ��ܣ��μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ����a����ȡ2.8500g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b����ȡ25.00mL������Һ����ƿ�У� c���������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL����
5Fe2++ | MnO4��+ | 8H+ | �T | 5Fe3++ | Mn2++ | 4H2O |
5 | 1 |
n��Fe2+�� 0.01000mol/L��0.0200L
����õ���n��Fe2+��=0.001mol��
��250mL��Һ�к�Fe2+=0.001mol�� ![]() =0.01mol��
=0.01mol��
FeSO47H2O���ʵ���Ϊ0.01mol������=0.01mol��278g/mol=2.78g��
��������= ![]() ��100%=97.54%��
��100%=97.54%��
���Դ��ǣ�97.54%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ���ǣ� ��
A.̼�������Һ�������������Ʋ����ȣ�NH4++OH�� ![]() H2O+NH3��
H2O+NH3��
B.Na218O2����H2O��2Na218O2+2H2O�T4Na++4OH��+18O2��
C.����þ��Һ�Ӱ�ˮ��Mg2++2NH3?H2O�TMg��OH��2��+2NH4+
D.������������ϡ���FeO+2H+�TFe2++H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ӧ�У�ˮ����ԭ�����ǣ�������
A.2H2+O2 ![]() 2H2O
2H2O
B.2F2+2H2O�T4HF+O2
C.SO3+H2O�TH2SO4
D.2Na+2H2O�T2NaOH+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�ʹ��ˮ��˵��,����ȷ����(����)
A.��Լ��ˮ
B.����������ˮ�ṹ,ʹ֮����Ч�����
C.��ֹʹ��ˮ���еĴ���ˮ
D.ʵ�ֵ���Ⱦ������Ⱦ�ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�ı����ǾɵĻ�ѧ�����µĻ�ѧ���γɣ����������ʵ����ɣ����б仯���������仯����
A.ʯ�͵ķ���B.ú�ĸ���
C.���������D.��ϩͨ����ˮ����ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��ӻ����ķ��������е���
A.��Br2ˮ�ɼ������Ҵ�
B.���������ͨ�����ȵ�ͭ����ȥN2�е�����O2
C.��KMnO4��Һ��ȥ��ϩ�е���Ȳ
D.������HNO3��ȥNaNO3��Һ��������Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X���ȷֽ⣬�ɵ�A��B��D��E��F��ˮ���ֲ������A��B��D������ѧ��ѧ�г��������������E�ǵ���F����Ԫ�ص��⻯�
��1��A������ǿ�ᡢǿ�д��A��ǿ����Һ��Ӧ�����ӷ���ʽ ��
��2��B��D�������������������Ԫ����ͬ��D����ˮ��ǿ�ᣬ��B��D�����г���Ԫ����������һ��Ԫ�������ڱ��е�λ���� ��
��3��E��ʹʪ��ĺ�ɫʯ����ֽ������ʵ������ȡE����Ļ�ѧ����ʽΪ �� �Ƶõ����������ͼ��ʾװ���ռ���������Ӧ�����A����B����ͨ�룮
��4���ɸ��ֽ��������ʵ���֮���Ʋ�X��������������������仯ѧʽΪ �� ����X��Ũ��Һ�еμ�ŨNaOH��Һ����������������Ϊ���� ��
��5��ȡһ������X����ֽ⣬������F 1mol�����ͬʱ��������mol�� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������12molL��1Ũ���������ˮ����500mL���ʵ���Ũ��Ϊ0.3molL��1��ϡ���ᣮ
��1����ѧ����Ҫ��ȡmL����Ũ����������ƣ�
��2�����ƹ�������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�Σ���
A��������ˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ����
B������Ͳȷ��ȡ����Ũ���ᣬ�ز����������ձ��У��ټ�������ˮ���ò���������������ʹ���Ͼ���
C��������ȴ�������ز�����ע��500mL����ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
��3������ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿�����������ƫ����ƫС��������Ӱ�족����
a������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��
b�����ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ
c��ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ��
d������ȡŨ�������Ͳ����ϴ�ӣ�����ϴ��Һת�Ƶ�����ƿ��
e������ƿϴ�Ӹɾ���δ����
��4�����ڱ�״���£���V LHCl���ܽ���1Lˮ�У�ˮ���ܶȽ���Ϊ1g/mL����������Һ���ܶ�Ϊ�� g/mL�������Һ��HCl���ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� �� 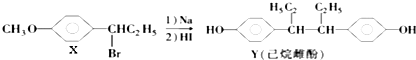
A.��NaOHˮ��Һ�м��ȣ�������X�ɷ�����ȥ��Ӧ
B.��һ�������£�������Y����Br2�����ӳɷ�Ӧ
C.��FeCl3��Һ�ɼ�����X��Y
D.������Y�в���������̼ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com