
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下图所示:
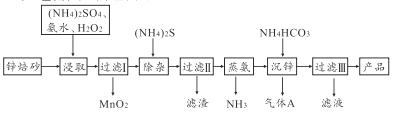
请回答下列问题:
(1)若(NH4)SO4和NH3·H2O的混合溶液呈中性,则溶液中的c(NH4+)____2c(SO42-)(填“>、“<”或“=”)。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________(任写一种)。
(3)适量S2-能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?_____[已知:Ksp(ZnS)=1.6×10-24.Ksp(CuS)=1.3×10-36]
(4)“沉锌”的离子方程式为________________。
(5)“过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式为___________。
【答案】 = 搅拌、适当加热、延长浸出时间(任写一种,答案合理即可) 可行 3Zn2++6HCO3-=2Zn(OH)2·ZnCO3↓+5CO2↑+H2O (NH4)2SO4
【解析】制备2Zn(OH)2·ZnCO3流程为:锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)中加入硫酸铵、氨水、双氧水,双氧水将锰离子氧化成二氧化锰,过滤后在滤液中加硫化铵,再过滤,除去铜离子,蒸氨除去多余的氨气,加入碳酸氢铵得到2Zn(OH)2·ZnCO3和二氧化碳气体,过滤得2Zn(OH)2·ZnCO3,滤液为硫酸铵溶液。
(1)(NH4)2SO4与NH3H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃时,pH=7是显中性的溶液,故c(H+)=c(OH-),所以c (NH4+)=2c(SO42-);(2)根据影响反应速率的因素判断“浸取”时为了提高锌的浸出率,可采取的措施为搅拌、适当加热;(3)根据反应ZnS+Cu2+=CuS+Zn2+,可知K=![]() =1.2×1012>>1×105,K>105化学反应完全,所以选择ZnS进行除杂是可行的;(4)“沉锌”的过程为溶液中的锌离子与碳酸氢铵溶液反应生成2Zn(OH)2·ZnCO3,离子方程式为3Zn2++6HCO3-=2Zn(OH)2·ZnCO3↓+5CO2↑+H2O;(5)“过滤3”所得滤液为硫酸铵溶液,可循环使用,其化学式为(NH4)2SO4。
=1.2×1012>>1×105,K>105化学反应完全,所以选择ZnS进行除杂是可行的;(4)“沉锌”的过程为溶液中的锌离子与碳酸氢铵溶液反应生成2Zn(OH)2·ZnCO3,离子方程式为3Zn2++6HCO3-=2Zn(OH)2·ZnCO3↓+5CO2↑+H2O;(5)“过滤3”所得滤液为硫酸铵溶液,可循环使用,其化学式为(NH4)2SO4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的溶胶能产生丁达尔效应
B.“青蒿一握,以水二升渍,绞取汁”,上述对青蒿素的提取过程属于化学变化
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组对以下三种品牌牙膏中摩擦剂成分进行调查,结果如下表.
牙膏品牌 | 两面针儿童牙膏 | 珍珠防臭牙膏 | 中华透明牙膏 |
摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
试回答下列问题:
(1)上述三种摩擦剂中属于酸性氧化物的是(填化学式,下同);既能与强酸反应又能与强碱反应的是 .
(2)两面针儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是 .
(3)从摩擦剂成分考虑,向珍珠防臭牙膏样品中滴加少量稀盐酸,可观察到的现象是 , 该反应的化学方程式为 .
(4)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,其反应原理是(用化学反应方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生铁炼钢的叙述错误的是( )。
A.添加必要的元素,改善钢材的组织结构和性能
B.适当降低生铁中的含碳量,除去大部分硫、磷等杂质
C.加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧
D.除去生铁中的非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3——物质结构与性质】
铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是_________________。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
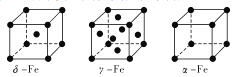
①δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为_____g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为__________。
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
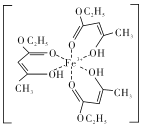
①此配合物中,铁离子的价电子排布式为_________。
②此配合物中碳原子的杂化轨道类型有_______。
③此配离子中含有的化学键有_____(填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G. δ键 H.π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com