
【题目】【选修3——物质结构与性质】
铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是_________________。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
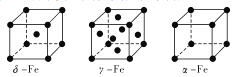
①δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为_____g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为__________。
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
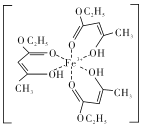
①此配合物中,铁离子的价电子排布式为_________。
②此配合物中碳原子的杂化轨道类型有_______。
③此配离子中含有的化学键有_____(填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G. δ键 H.π键
【答案】 第四周期第VIII族 4:3 4 ![]() 分子晶体 3d5 sp2杂化、sp3杂化 CDEGH
分子晶体 3d5 sp2杂化、sp3杂化 CDEGH
【解析】(1)Fe元素在周期表中的位置为第四周期第Ⅷ族。(2)①δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3;②γ晶体晶胞中所含有的铁原子数为8×1/8+6×1/2=4;③δ晶胞为体心立方(堆积),体心立方中含有1+8×1/8=2,体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为: ![]() ,晶胞体积为:(
,晶胞体积为:(![]() )3,因此密度是
)3,因此密度是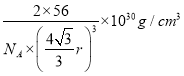 ;(3)三氯化铁晶体的熔沸点较低,易溶于有机溶剂,因此形成的是分子晶体;(4)①铁元素是26号元素,铁原子核外有26个电子,根据构造原理知其基态原子核外电子排布式,铁原子失去3个电子变为铁离子,铁离子核外有23个电子,3d电子为其价电子,铁离子3d能级上有5个电子,4s能级上没有电子,所以其价电子排布式为:3d5;②该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化;③同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键,所以该化合物中碳碳原子之间存在非极性共价键,碳和氧原子或氢原子之间存在极性共价键,铁离子和氧原子之间存在配位键,则该化合物中含有配位键、极性键、非极性键、σ键和π键,答案选CDEGH。
;(3)三氯化铁晶体的熔沸点较低,易溶于有机溶剂,因此形成的是分子晶体;(4)①铁元素是26号元素,铁原子核外有26个电子,根据构造原理知其基态原子核外电子排布式,铁原子失去3个电子变为铁离子,铁离子核外有23个电子,3d电子为其价电子,铁离子3d能级上有5个电子,4s能级上没有电子,所以其价电子排布式为:3d5;②该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化;③同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键,所以该化合物中碳碳原子之间存在非极性共价键,碳和氧原子或氢原子之间存在极性共价键,铁离子和氧原子之间存在配位键,则该化合物中含有配位键、极性键、非极性键、σ键和π键,答案选CDEGH。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下图所示:
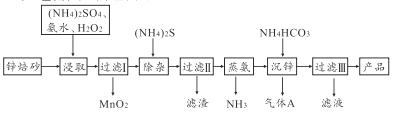
请回答下列问题:
(1)若(NH4)SO4和NH3·H2O的混合溶液呈中性,则溶液中的c(NH4+)____2c(SO42-)(填“>、“<”或“=”)。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________(任写一种)。
(3)适量S2-能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?_____[已知:Ksp(ZnS)=1.6×10-24.Ksp(CuS)=1.3×10-36]
(4)“沉锌”的离子方程式为________________。
(5)“过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以石膏(CaSO4·2H2O)为主要原料制备(NH4)2SO4的流程如下:

下列说法正确的是( )
A. 气体B是NH3,可循环利用
B. 操作Ⅰ中,所用的主要玻璃仪器为烧杯、玻璃棒、分液漏斗
C. 操作Ⅱ中,可用蒸发结晶的方法得到纯净的(NH4)2SO4
D. 整个过程的总反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5——有机化学基础】
某新型有机化学材料G的合成路线如图所示,请回答下列问题:
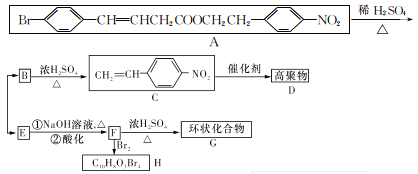
(1)F分子中的含氧官能团名称为_______。
(2)高聚物D的结构简式是_______。
(3)写出反应A→B+E的化学方程式:________。
(4)F→H的反应类型有______、_________。
(5)B的同分异构体有多种,其中官能团种类不变,能与FeCl3溶液发生显色反应,核磁共振氢谱显示有6组峰,且峰面积之比为1:1:1: l:2:3的同分异构体有_____种。
(6)参照上述合成路线,以CH3CHBrCOOCH3为原料(无机试剂任选),设计制备聚乳酸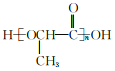 的合成路线_____________________。
的合成路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是

A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11
C. 在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D. 0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的5种物质中均含同种金属元素,且在一定条件下(不含电解)能按图示箭头方向实现一步转化,则该金属元素可能是

①Na②K③Ca④Fe⑤Cu
A. ①② B. ③④ C. ④⑤ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的速率可表示为( )
A.v(NH3)=0.01 molL﹣1s﹣1
B.v(O2)=0.001 molL﹣1s﹣1
C.v(NO)=0.001 molL﹣1s﹣1
D.v(H2O)=0.045 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A,B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A , B , C , D . (填元素符号)
(2)A,B,C元素各自形成的氢化物的稳定性由强到弱的顺序是 (填化学式,下同)
(3)A与B形成的三原子分子的电子式是 , B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com