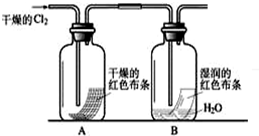
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH
4)
2SO
4溶液,连接的顺序(用接口序号字母表示)是:a
.
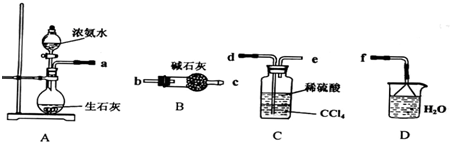
(2)将装置C中两种液体分离开的操作名称是
.装置D的作用是
.
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:
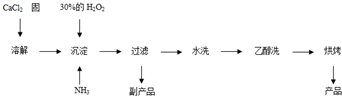
已知CaO
2?8H
2O呈白色,微溶于水.I
2+2S
2O
32-=2I
-+S
4O
62-(1)用上述方法制取CaO
2?8H
2O的化学方程式是
;
(2)检验“水洗”是否合格的方法是
;
(3)测定产品中CaO
2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H
2SO
4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L
-1的Na
2S
2O
3溶液至反应完全,消耗Na
2S
2O
3溶液V mL.
①判断此滴定实验达到终点的方法是:
.
②CaO
2的质量分数为
(用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO
2的质量分数可能
(填“不受影响”、“偏低”或“偏高”).





 阅读快车系列答案
阅读快车系列答案