
Ϊ�˷�ֹ�ȴ������ˮ����������豣��ˮ��Cu2+��Ũ��Լ1��2��10-5 mol��L-1��Ϊ������ÿ�λ���ˮʱ��ҺŨ�ȵĸı䣬�ɰ��ʵ��ĺ�ͭ��������ڳصף��䱥����Һ�ṩ�ʵ���Cu2+����֪CuS��Cu(OH)2��CuCO3��Kspֵ����Ϊ1��3��10-36��2��2��10-20��1��4��10-10���������������У��������ˮŨ��Ҫ����ǣ� ��
A��CuSO4 B��CuCO3 C��Cu(OH)2 D��CuS
B
��������
���������A�� CuSO4 �����ܽ���ˮ�����Һ�е�c(Cu2+)>>1��2��10-5 mol/L ������B��CuCO3��Ksp=1��4��10-10����c(Cu2+)= ��1��2��10-5 mol/L����ȷ��C�� Cu(OH)2
��1��2��10-5 mol/L����ȷ��C�� Cu(OH)2 Cu2++2OH-������c(Cu2+)=x,��c(OH-)=2x, Ksp= c(Cu2+)��c2(OH-)=2��2��10-20��x��(2x)2=2��2��10-20��
Cu2++2OH-������c(Cu2+)=x,��c(OH-)=2x, Ksp= c(Cu2+)��c2(OH-)=2��2��10-20��x��(2x)2=2��2��10-20�� <<1��2��10-5 mol/L������D�� CuS KspֵΪ1��3��10-36��������Һ�е�c(Cu2+)=
<<1��2��10-5 mol/L������D�� CuS KspֵΪ1��3��10-36��������Һ�е�c(Cu2+)= <<1��2��10-5 mol/L������
<<1��2��10-5 mol/L������
���㣺��������ܽ�ƽ������ֳҵ��Ӧ�õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015������ʡ������ѧ���ڳ���⻯ѧ�Ծ��������棩 ���ͣ��ƶ���
ͼ�и���������ѧ��ѧ�г��������ʣ��ס��Ҿ������ӻ���������������Ӹ�����Ϊ1��1�����Ƿ��ͷ۵���Ҫ�ɷ֣�����һ�ֳ��õĻ��ʣ�B��D���³�ѹ�������塣��ش��������⣺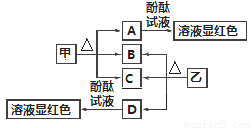
��1����������________��
��2��A��D���ʵ�ˮ��Һ�ֱ�����̪��Һ����Һ���Ժ�ɫ����ԭ��________(���ͬ������ͬ��)��
��3�����ڳ�ʪ�Ŀ����лỺ���ֽ⣬A�����տ����е�ˮ�֣�A��nH2O===A��nH2O(nΪƽ��ֵ��n��10)��ȡû�����Ʊ��ܵļ���Ʒ9.16 g������ˮ�Ƴ���Һ����������ϡ���Ტ��ͣ�ؽ��裬�����������������ɵ�B�����(��״��)���±���(����ˮ�е�B����)
��������(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
����B�����(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
��
�� ϡ��������ʵ���Ũ��Ϊ__________________________________��
�� ��Ʒ�еijɷּ������ʵ����ֱ�Ϊ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ��˳����У������߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������������һ���������ܹ��棬��������Ӧ�Լ���ᷢ����ѧ�仯�����������ӷ���ʽ��ȷ���ǣ� ��
ѡ�� | ������ | �����Լ� | �����Լ�������Ӧ�����ӷ���ʽ |
A | Fe2����NO | ϡ���� | 3Fe2����NO |
B | Fe3����I����ClO�� | ����������Һ | Fe3����3OH��===Fe(OH)3�� |
C | Ba2����HCO | ����������Һ | HCO |
D | Al3����Cl����NO | ��������������Һ | Al3����3OH��===Al(OH)3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и���8���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��14�֣���̬������A�����ֶ�����Ԫ����ɣ�����ˮ�������ֽⷴӦ������ͬѧ����ͼװ�ã��г�װ���ԣ��������̽��ʵ�顣
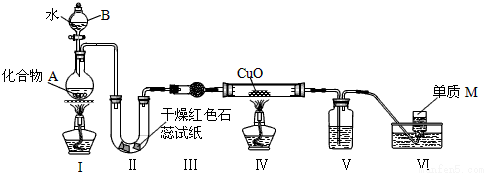
��1������B��������____________��
��2�������У����е���ֽ���������к�ɫ��ĩ��Ϊ��ɫ����M���ɣ�����е��Լ�Ϊ__________________����������Ӧ�Ļ�ѧ����ʽΪ____________�����е��Լ�Ϊ____________________��
��3������ͬѧ����ͬ��ʵ�飬��װ������˳��Ϊ������������������������ʱ��������Ϊ________��ԭ����__________________��
��4����������Ӧ��2.5g ������A�����Ͽɵ�0.56L����״����M����A�Ļ�ѧʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и���8���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A����֬�����ۡ������ʾ�Ϊ��ˮ��ĸ߷��ӻ�����.
B���ձ������˵�վ��ըʱ�ͷŵ����ַ����Ժ���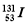 ��
��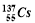 �����������.
�����������.
C�������������Ȼ���ע��Һ���ڽ���.
D��Ϊ��ֹ����е��ؽ�������Ⱦ������ˮ�壬Ӧ���������ϵ�ص��ۺ����ü���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ���ݰ��и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ᡢ�����̼�������������г��������ʡ����б�����ȷ���ǣ� ��
A����NaHCO3��Һ�м�����������ʵ�����NaOH����Һ�е�������ֻ��CO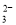 ��OH-
��OH-
B��NaHCO3��Һ�У�c(H+)+c(H2CO3)=c(OH-)
C��10 mL0��20mol��L-1CH3COOH��Һ����10 mL0��10mol��L-1��NaOH����Һ�У�c(CH3COO-)+c(CH3COOH)= 0��10mol��L-1
D���к������pH����ͬ��HCl��Һ��CH3COOH��Һ�����ĵ�NaOH���ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ���ݰ��и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�ڿ�������������һ�����ӵ����ģ��ͼ�� ��

ͼ�С���������������˫������������ͬ��ɫ���������ͬԪ�ص�ԭ�ӣ���ģ��ͼ�ɴ���һ��
A�������� B���� C�������� D���Ҵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ�ڵ�һ�μ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ijδ֪��Һ���ܺ�Cl�D��CO32�D��Na����SO42�D��Al3��������Һ������ɫʯ����ֽ�ϣ���ֽ��졣ȡ������Һ���μ������ữ���Ȼ�����Һ���а�ɫ�������ɣ����ϲ���Һ�еμ���������Һ��������ɫ�����������жϺ�������
A��һ����Cl�D B��һ����SO42�D C��һ��û��Al3�� D��һ����CO32�D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ���¿���ѧ�Ծ��������棩 ���ͣ������
��10�֣�ͭ�Ͻ�������ʹ������Ľ������ϣ�ͭ�ڻ������еij������ϼ���+l��+2����֪Cu2O��ϡ���ᷴӦ����Һ����ɫ������Cu��Cu2O��CuO��ɵĻ�����У�����1 L 0.6 mol/L HNO3��Һǡ��ʹ������ܽ⣬ͬʱ�ռ���2240 mL NO���壨��״��������ش��������⣺
��1��д��Cu2O��ϡ���ᷴӦ�����ӷ���ʽ���������������������������������� ��
��2�����������������������H2���Ȼ�ԭ�����õ����������Ϊ���������� ��
��3����������к�0.1 mol Cu�����û������ϡ�����ַ�Ӧ������H2SO4�����ʵ���Ϊ
��������������
��4�����������Cu�����ʵ���Ϊn mol����n��ȡֵ��ΧΪ�������������������� ��
��5����ѧ�о�����������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ������ڼ�����������Һ̬�£�N2H4����ԭ����Cu(OH )2���Ʊ�����Cu2O��ͬʱ�ų�N2�����ռ���N2���Ϊ 3.36L���ѻ���Ϊ��״����ʱ�����Ʊ�����Cu2O������Ϊ������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com