
| a | b | c | |
| �� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
| �� | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
| �� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
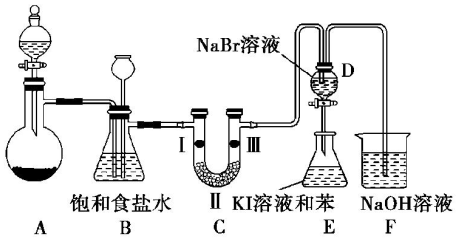
 ���������� D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ���������ܣ� ��ܡ����ܡ���˵��Br2�������Դ���I2��
���������� D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ���������ܣ� ��ܡ����ܡ���˵��Br2�������Դ���I2������ ��1����KClO3+6HCl=KCl+3Cl2��+3H2O��Ӧ��֪��KClO3��ClԪ�صĻ��ϼ���+5�۽���Ϊ0��HCl��ClԪ�صĻ��ϼ���-1������Ϊ0���Դ������
��2����Ӧ��ȡ�������к����Ȼ��⣬װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl��װ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ����
��3����֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�
��4��D���������廯�Ʒ�Ӧ�����Ȼ��ƺ��嵥�ʣ���������װ��D��������Һ����װ��E�У����ɵ��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ���ܽ��ڱ��У��ֲ㣬�������ϲ㣻��������ǿ�����ԣ����ڹ���������Ҳ�ܹ����������ӣ���˵���嵥��������ǿ�ڵⵥ�ʣ�
��5������ԭ���غ������
��� �⣺��1����HCl��ClԪ�صĻ��ϼ����ߣ���HClΪ�÷�Ӧ�еĻ�ԭ����KClO3�е�Cl�Ļ��ϼ۽��ͱ���ԭ��KClO3������������������Ȼ�ԭ�������ʵ���֮��Ϊ5��1������Ӧ����������Ȼ�ԭ����� 1mol������������Ϊ1.25mol����ԭ����Ϊ0.25mol������ת�Ƶĵ�����ĿΪ2.5NA��
�ʴ�Ϊ��KClO3��HCl��2.5NA��
��2��װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl��װ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ������ƿ��Һ���½�������©����Һ��������
�ʴ�Ϊ�����ӺͰ�ȫƿ����ƿ�е�Һ���½�������©���е�Һ��������
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����ab�Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ������
�ʴ�Ϊ��c��
��4��D���������廯�Ʒ�Ӧ�����Ȼ��ƺ��嵥�ʣ���Ӧ�����ӷ���ʽ����˫���ŷ���ʾ������ת������� ����������װ��D�к��嵥�ʵ�������Һ�����ʵ⻯�غͱ���װ��E�У��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�����ڱ����Ϻ�ɫ�����۲쵽�������ǣ�E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ����������ǿ�����ԣ������������ܹ��������������ɵⵥ�ʣ����Ը�������˵����ķǽ�����ǿ�ڵ⣻
����������װ��D�к��嵥�ʵ�������Һ�����ʵ⻯�غͱ���װ��E�У��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�����ڱ����Ϻ�ɫ�����۲쵽�������ǣ�E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ����������ǿ�����ԣ������������ܹ��������������ɵⵥ�ʣ����Ը�������˵����ķǽ�����ǿ�ڵ⣻
�ʴ�Ϊ�� �����ܣ�
�����ܣ�
��5����֪Cl2��NaOH��Ӧʱ�����п�����NaCl��NaClO��NaClO3����ԭ���غ��֪��n��Cl2��=$\frac{1}{2}$n��NaOH��=0.5L��0.2mol/L��$\frac{1}{2}$=0.05mol�������µ�Cl2�����Ϊ1.12L��
�ʴ�Ϊ��1.12��
���� �������������Ʊ�Ϊ���忼�������������ʡ�������ԭ��Ӧ��˫���ŷ���ʾ������ת�ơ�������ԭ��Ӧ�ļ��㣬��Ŀ�Ѷ��еȣ�����ʱע��������������ʡ��Ʒ���װ�õ����ü�������ԭ��Ӧԭ��Ϊ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl��aq��+NaOH ��aq���TNaCl ��aq��+H2O ��l����H��0 | |
| B�� | 2CH3OH ��l��+3O2 ��g���T2CO2 ��g��+4H2O ��l����H��0 | |
| C�� | 2FeCl3��aq��+Fe��s���T3FeCl3��aq����H��0 | |
| D�� | 2H2��g��+O2��g���T2H2O ��l����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na��O | B�� | Na+��O2- | C�� | Mg��Na | D�� | ?����2+��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10��1 | B�� | 100��1 | C�� | 1��100 | D�� | ��ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
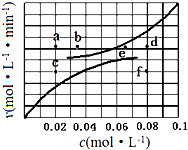 ��1.0L�ܱ������з���0.10molA��g������һ���¶Ƚ������·�Ӧ��
��1.0L�ܱ������з���0.10molA��g������һ���¶Ƚ������·�Ӧ��| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| ��ѹǿp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c��A��/��mol•L-1�� | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com