
| A. | 10:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化 | |
| C. | 生石灰制熟石灰 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
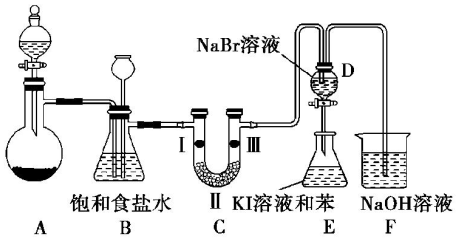
| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
 .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.
.打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
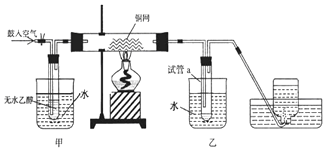
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
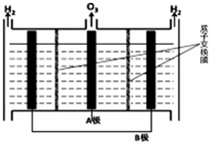 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
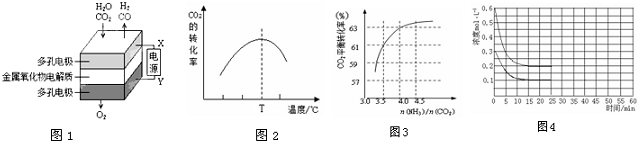
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com