
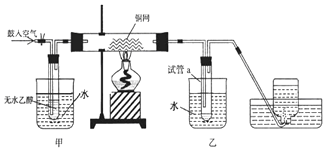
分析 (1)乙醇在铜做催化剂条件被氧气氧化成乙醛,属于加氧的氧化反应,方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,熄灭酒精灯,反应仍能继续进行,说明该反应是放热反应;
(2)依据乙醇和乙醛的物理性质:二者都容易挥发.乙醇是反应物,应转化成乙醇蒸汽进入到硬质试管内参与反应;乙醛是产物,降低温度使其转化成液态,所以前者用热水浴,后者用冷水浴;
(3)乙醇被氧化为乙醛,同时生成水,反应乙醇不能完全反应,故a中冷却收集的物质有乙醛、乙醇与水;能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应.
解答 解:(1)发生反应时,铜丝首先变黑,是因为发生反应:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;后来变红,发生反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,该反应是乙醇的催化氧化,铜在反应中做催化剂;熄灭酒精灯,反应仍能继续进行,说明该反应时一个放热反应,
故答案为:红;黑;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CuO+CH3CH2OH$\stackrel{△}{→}$CH3CHO+Cu+H2O;
(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发与空气中的氧气混合,有利于下一步反应;乙处作用为冷水浴,降低温度,使生成的乙醛冷凝成为液体,沉在试管的底部,
故答案为:使乙醇受热挥发;冷凝生成的反应物;
(3)乙醇被氧化为乙醛,同时生成水,反应乙醇不能完全反应,故a中冷却收集的物质有乙醛、乙醇与水,主要为乙醛,试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:CH3CHO;c.
点评 本题为乙醇化学性质的实验综合题,为高频考点,侧重于学生的分析能力和实验能力的考查,题目涉及有机方程式书写、对装置的理解评价、物质的分离提纯等,难度中等,注意理解乙醇催化氧化原理.


科目:高中化学 来源: 题型:实验题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c(A)/(mol•L-1) | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知如图所示的可逆反应:
(1)已知如图所示的可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com