
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |
分析 为提高该反应的反应速率,可增大浓度、压强或加入催化剂、升高温度,提高NO的转化率,应使平衡向正反应方向移动,以此解答该题.
解答 解:A.加催化剂同时升高温度,反应速率增大,因正反应为放热反应,则平衡逆向移动,NO转化率降低,故A错误;
B.升高温度同时充入N2,平衡向逆反应方向移动,NO的转化率降低,故B错误;
C.加入催化剂同时增大压强,反应速率增大,平衡向正反应方向移动,NO的转化率增大,故C正确;
D.降低温度同时增大压强,反应速率不一定增大,可能减小,故D错误.
故选C.
点评 本题考查化学反应速率的影响,侧重于基本理论知识的考查,难度不大,注意把握反应的特点,为解答该题的关键,也是易错点,学习中注意相关基础知识的积累.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | B. | 胶体粒子直径在1nm~100nm之间 | ||
| C. | 胶体具有丁达尔现象 | D. | 胶体和其它分散系都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
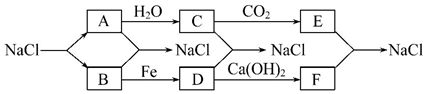
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3周期ⅡB族 | B. | 第4周期ⅡB族 | C. | 第4周期ⅦB族 | D. | 第4周期Ⅷ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ②④⑤⑦ | C. | 只有⑤ | D. | 均不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
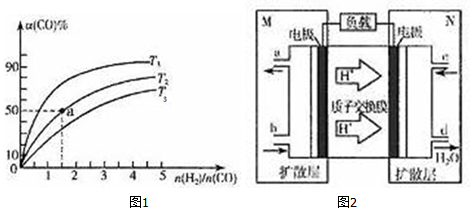
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
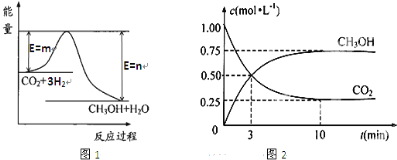
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com