
| A. | ①③⑤⑥ | B. | ②④⑤⑦ | C. | 只有⑤ | D. | 均不对 |
分析 ①电解质的强弱和物质的溶解性之间没有必然的联系;
②FeCl3+3KSCN?Fe(SCN)3+3KCl平衡的移动和氯离子浓度之间没有关系;
③根据反应自发进行的判据△H-T△S<0来判断;
④活化分子之间的碰撞不一定为有效碰撞,要有一定的取向;
⑤熔融的电解质都能导电
⑥勒夏特列原理用于判断可逆反应是否达到平衡状态.
⑦给体系加压(压缩),活化分子百分数不变.
解答 解:①电解质的强弱和物质的溶解性之间没有必然的联系,不溶于水的盐(CaCO3、BaSO4等)在熔融状态下都完全电离,都是强电解质,故错误;
②FeCl3+3KSCN?Fe(SCN)3+3KCl平衡的移动和氯离子浓度之间没有关系,加入少量KCl固体,溶液颜色不变,故错误;
③反应自发进行的判据△H-T△S<0,反应4A (g)+B(g)═2C(g)+D(g)△S<0,反应不能自发进行,△H大于零时,低温下不自发,故错误;
④活化分子之间的碰撞不一定为有效碰撞,当发生化学反应的碰撞才是有效碰撞,故错误;
⑤熔融的电解质不一定都能导电,如HCl在熔融状态下不导电,故错误;
⑥勒夏特列原理用于判断可逆反应达到平衡状态在外界条件的改变下是否会发生移动,故错误;
⑦给体系加压(压缩),活化分子百分数不变,但浓度增大,反应速率增大,故错误;
故选D.
点评 本题考查综合考查化学平衡的影响因素、强弱电解质的概念,为高频考点,侧重于双基的考查,题目难度不大.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
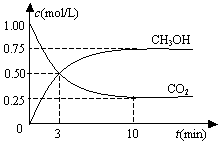 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol| A. | 反应进行到3 min时,该反应达到平衡状态 | |
| B. | 从反应开始到平衡,CO2的转化率为25% | |
| C. | 第3 min时,氢气的平均反应速率为1.5mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
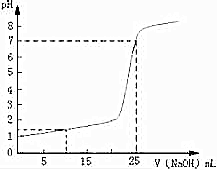 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中的碳原子有sp3和sp2两种杂化类型 | |
| C. | 丙烯分子的所有原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com