
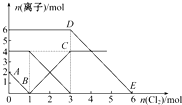
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |


科目:高中化学 来源: 题型:
| A、2v正(X)=v逆(Y) |
| B、单位时间内生成1 mol Y的同时生成2 mol X |
| C、混合气体的密度不再变化 |
| D、反应容器中Y的质量分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1:c2=1:3 |
| B、该反应一定是朝正向反应建立平衡 |
| C、X、Y的转化率相等 |
| D、c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
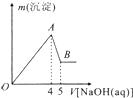 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、3:1 | D、6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
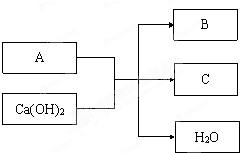
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 起始 | 5min | 10min | 15min | 20min | 25min | 30min |
| A浓度(mol?L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
| B浓度(mol?L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
| D浓度(mol?L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
| A、反应在前10min的平均反应速率v(D)=0.3mol?L-1?min-1 | ||
B、该反应的平衡常数表达式K=
| ||
| C、若平衡时保持温度不变,压缩容器体积平衡不移动 | ||
| D、反应至15min时,改变的条件可以是升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com