
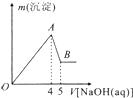
 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、3:1 | D、6:1 |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
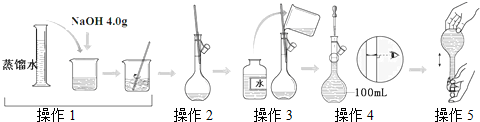
| A、所配制的NaOH溶液物质的量浓度为1.0 mol/L |
| B、操作2是将NaOH加水溶解后直接转移到容量瓶中 |
| C、操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D、操作5中,定容摇匀后发现液面低于刻度线,不能再继续加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里 出现凝胶 | 酸性:盐酸>硅酸 |
| B | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生变性 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向某溶液中先滴加KSCN溶液, 再滴加少量氯水 | 先无明显现象, 后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
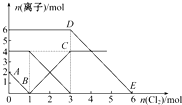 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
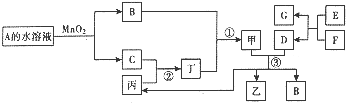 已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).
已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
| A、由图可知:T1<T2,且该反应为吸热反应 |
| B、T2时该反应的平衡常数K=0.8 |
| C、前10min乙、丙两容器中v(A)乙>v(A)丙 |
| D、C的质量m:m甲=m乙<2m丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com