
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里 出现凝胶 | 酸性:盐酸>硅酸 |
| B | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生变性 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向某溶液中先滴加KSCN溶液, 再滴加少量氯水 | 先无明显现象, 后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度均为0.1mol?L-1的小苏打溶液与烧碱溶液等体积混合c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| B、某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| C、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、常温下,10mLpH=12的Ba(OH)2溶液与40mLcmol?-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
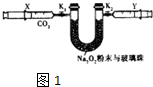 (1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
(1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
查看答案和解析>>
科目:高中化学 来源: 题型:
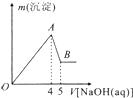 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、3:1 | D、6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Al3+、Fe3+ |
| B、SiO32-、[Al(OH)4]-、K+ |
| C、Ag+、Cu2+、Na+ |
| D、Ag+、Ba2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时化学能转变为电能 |
| B、放电时CH3OH参与正极反应 |
| C、充电时阴极产CH3OH |
| D、充电时每生成1molCH3OH,则转移6mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com