
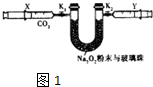
 (1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
(1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
| 16g |
| 0.32g |
| 2mol |
| nmol |


科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是内层电子数的2倍 |
| Y | Y与X同周期,其基态原于占据s轨道的电子数与占据p轨道的电子数相同 |
| Z | Z是X的同族相邻元素 |
| W | 原子序数为29 |
| Q | Q与Z同周期,且在该周期所有元素中原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
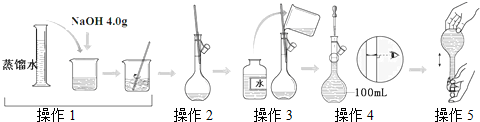
| A、所配制的NaOH溶液物质的量浓度为1.0 mol/L |
| B、操作2是将NaOH加水溶解后直接转移到容量瓶中 |
| C、操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D、操作5中,定容摇匀后发现液面低于刻度线,不能再继续加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里 出现凝胶 | 酸性:盐酸>硅酸 |
| B | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生变性 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向某溶液中先滴加KSCN溶液, 再滴加少量氯水 | 先无明显现象, 后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
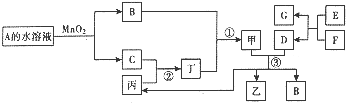 已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).
已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室废液可直接排入下水道 |
| B、制备有毒气体应在通风橱内进行 |
| C、配制稀硫酸时将水倒入浓硫酸中并不断搅拌 |
| D、不慎洒出的酒精在桌上着火时,立即用大量水扑灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com