
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是内层电子数的2倍 |
| Y | Y与X同周期,其基态原于占据s轨道的电子数与占据p轨道的电子数相同 |
| Z | Z是X的同族相邻元素 |
| W | 原子序数为29 |
| Q | Q与Z同周期,且在该周期所有元素中原子半径最大 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、水银、干冰、硫酸、苛性钠、镁铝合金 |
| B、碘酒、冰、盐酸、烧碱、食盐 |
| C、氢气、二氧化硫、硝酸、纯碱、胆矾 |
| D、铜、氧化铜、醋酸、熟石灰、醋酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
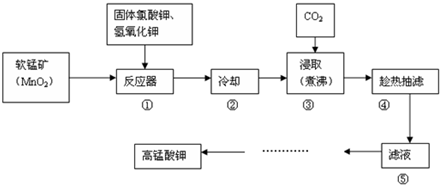
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
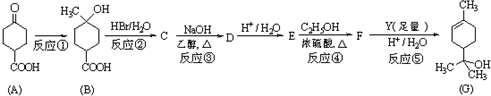
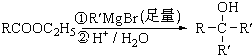
查看答案和解析>>
科目:高中化学 来源: 题型:
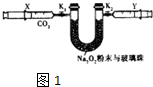 (1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
(1)如图1注射器X中抽取100mL CO2,U形管中装有适量小玻璃珠和约1.5gNa2O2粉末,打开K1、K2止水夹,缓缓将CO2压至U形管中,观察到的实验现象是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com