


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、肯定有Na2CO3,没有Ba(NO3)2 |
| B、肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 |
| C、肯定没有Na2CO3,Ba(NO3)2 |
| D、无法判断何种为肯定或否定的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | - | ↓ | ↓ |
| D | - | - | ↓ | - | ↓ | ↓ | ↓ |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是内层电子数的2倍 |
| Y | Y与X同周期,其基态原于占据s轨道的电子数与占据p轨道的电子数相同 |
| Z | Z是X的同族相邻元素 |
| W | 原子序数为29 |
| Q | Q与Z同周期,且在该周期所有元素中原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| ③ | 加足量BaCl2溶液时,所得沉淀为6.27g,向沉淀中加足量稀盐酸,然后干燥、称量为2.33g. | |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
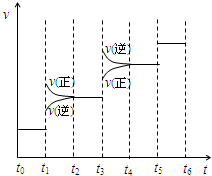 氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com