
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.| 醇 |
| △ |
| H2O |
| △ |
| H2O |
| △ |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| A、直径介于1nm~100nm之间的微粒称为胶体 |
| B、胶体加入电解质可产生沉淀,而溶液不能 |
| C、可用渗析法分离Fe(OH)3胶体和FeCl3溶液的混合物 |
| D、胶体区别于其它分散系的本质特性是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
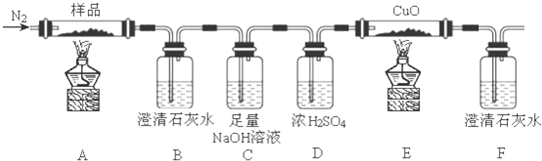
查看答案和解析>>
科目:高中化学 来源: 题型:
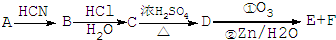
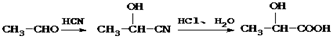
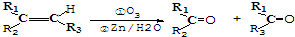
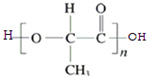 )的合成路线流程图(无机试剂任选用).
)的合成路线流程图(无机试剂任选用).
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | - | ↓ | ↓ |
| D | - | - | ↓ | - | ↓ | ↓ | ↓ |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是内层电子数的2倍 |
| Y | Y与X同周期,其基态原于占据s轨道的电子数与占据p轨道的电子数相同 |
| Z | Z是X的同族相邻元素 |
| W | 原子序数为29 |
| Q | Q与Z同周期,且在该周期所有元素中原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com