
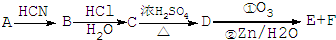
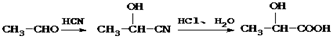
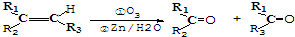
 )的合成路线流程图(无机试剂任选用).
)的合成路线流程图(无机试剂任选用).
| 7.2g |
| 18g/mol |
| 0.8mol |
| 0.1mol |
| 0.4mol×2 |
| 0.1mol |
| 120-12×8-8 |
| 16 |
 ,由信息Ⅰ可知,A与HCN发生加成反应生成B为
,由信息Ⅰ可知,A与HCN发生加成反应生成B为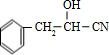 ,B发生水解反应生成C为
,B发生水解反应生成C为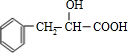 ,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,应为发生消去反应,故D为
,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,应为发生消去反应,故D为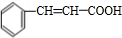 ,
,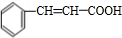 发生氧化反应生成E与F,由信息Ⅱ可知氧化为
发生氧化反应生成E与F,由信息Ⅱ可知氧化为 、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为
、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为 ,G为HOOC-COOH,据此解答.
,G为HOOC-COOH,据此解答.| 7.2g |
| 18g/mol |
| 0.8mol |
| 0.1mol |
| 0.4mol×2 |
| 0.1mol |
| 120-12×8-8 |
| 16 |
 ,由信息Ⅰ可知,A与HCN发生加成反应生成B为
,由信息Ⅰ可知,A与HCN发生加成反应生成B为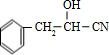 ,B发生水解反应生成C为
,B发生水解反应生成C为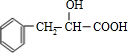 ,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,应为发生消去反应,故D为
,C在浓硫酸、加热条件下生成D,D能使溴的四氯化碳溶液褪色,应为发生消去反应,故D为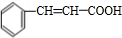 ,
,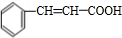 发生氧化反应生成E与F,由信息Ⅱ可知氧化为
发生氧化反应生成E与F,由信息Ⅱ可知氧化为 、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为
、OHC-COOH,F继续被氧化生成G,G的相对分子质量为90,故F为OHC-COOH,E为 ,G为HOOC-COOH,
,G为HOOC-COOH, ,含氧官能团的名称是醛基,故答案为:醛基;
,含氧官能团的名称是醛基,故答案为:醛基; ;
; 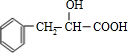 ,含有苯环,可以与氢气发生加成反应,含有羟基,可以与甲酸发生酯化反应,含有羧基,能与氢氧化钠发生中和反应,不能发生水解反应,不能与银氨溶液反应,故选:ACE;
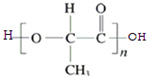
,含有苯环,可以与氢气发生加成反应,含有羟基,可以与甲酸发生酯化反应,含有羧基,能与氢氧化钠发生中和反应,不能发生水解反应,不能与银氨溶液反应,故选:ACE;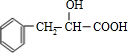 )的同分异构体有多种,符合下列条件的同分异构体:
)的同分异构体有多种,符合下列条件的同分异构体: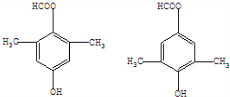 ,故答案为:
,故答案为: ;
; ,合成路线流程图为:
,合成路线流程图为: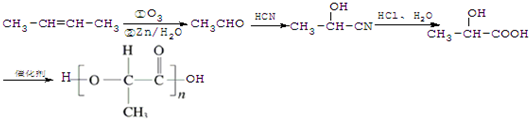 ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验步骤 | 现象 | 探究目的和结论 |
| ① | 将刚削皮的苹果立刻放入隔绝空气的环境中 | 相当长一段时间内,无明显变化 | |
| ② | 将刚削皮的苹果立刻放入90℃~95℃的水中2min,再放在空气中. 再将另一块刚削皮的苹果立刻放入稀盐酸中浸泡2min后取出洗净,再放在空气中.将盐酸改为酒精、醋酸铅溶液进行相同实验. | 相当长一段时间内,均无明显变化 | |
| ③ | 在刚削皮的苹果上滴加FeCl3溶液. | 苹果由白色变为绿色 | 探究目的:探究苹果中是否含有酚类物质.结论:苹果中含有酚类物质. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Fe2+ Ba2+ NH4+ |
| 阴离子 | OHˉ NO3ˉ Iˉ HCO3ˉ AlO2ˉ HSO4ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com