
| 阳离子 | K+ Na+ Fe2+ Ba2+ NH4+ |
| 阴离子 | OHˉ NO3ˉ Iˉ HCO3ˉ AlO2ˉ HSO4ˉ |
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
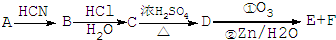
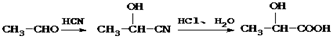
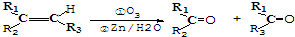
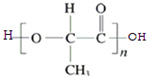 )的合成路线流程图(无机试剂任选用).
)的合成路线流程图(无机试剂任选用).
查看答案和解析>>
科目:高中化学 来源: 题型:
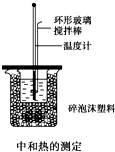 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧, 火焰呈淡蓝色 | 气体成分为 |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 | 白色不溶物中含有MgCO3 | |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- 离子 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com