
| A、浓度均为0.1mol?L-1的小苏打溶液与烧碱溶液等体积混合c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| B、某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| C、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、常温下,10mLpH=12的Ba(OH)2溶液与40mLcmol?-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液pH=11 |
| 1 |
| 2 |
| 0.01mol/L×0.01L-0.00125mol/L×0.04L |
| 0.05L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧, 火焰呈淡蓝色 | 气体成分为 |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 | 白色不溶物中含有MgCO3 | |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- 离子 |

查看答案和解析>>
科目:高中化学 来源: 题型:
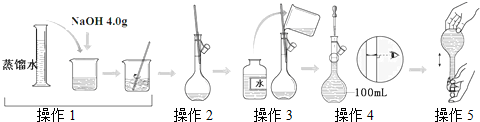
| A、所配制的NaOH溶液物质的量浓度为1.0 mol/L |
| B、操作2是将NaOH加水溶解后直接转移到容量瓶中 |
| C、操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D、操作5中,定容摇匀后发现液面低于刻度线,不能再继续加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里 出现凝胶 | 酸性:盐酸>硅酸 |
| B | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生变性 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向某溶液中先滴加KSCN溶液, 再滴加少量氯水 | 先无明显现象, 后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两溶液中由水电离的c(H+)前者小于后者 |
| B、两溶液分别和足量的锌反应,生成氢气的体积相等 |
| C、两溶液分别和相同的锌反应,生成氢气的起始速率相等 |
| D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,都呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com