
| A、Ag+、Al3+、Fe3+ |
| B、SiO32-、[Al(OH)4]-、K+ |
| C、Ag+、Cu2+、Na+ |
| D、Ag+、Ba2+、Na+ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 阳离子 | Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里 出现凝胶 | 酸性:盐酸>硅酸 |
| B | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生变性 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向某溶液中先滴加KSCN溶液, 再滴加少量氯水 | 先无明显现象, 后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
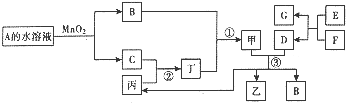 已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).
已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应2H2O═2H2+O2在任何条件下都不会自发进行 | ||
B、溶液CH3COOH加水稀释后,溶液中
| ||
| C、温度升高,反应物的活化分子数增多,主要因素是分子的运动加快,反应速率加快 | ||
| D、Na2CO3液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
| A、由图可知:T1<T2,且该反应为吸热反应 |
| B、T2时该反应的平衡常数K=0.8 |
| C、前10min乙、丙两容器中v(A)乙>v(A)丙 |
| D、C的质量m:m甲=m乙<2m丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两溶液中由水电离的c(H+)前者小于后者 |
| B、两溶液分别和足量的锌反应,生成氢气的体积相等 |
| C、两溶液分别和相同的锌反应,生成氢气的起始速率相等 |
| D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,都呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室废液可直接排入下水道 |
| B、制备有毒气体应在通风橱内进行 |
| C、配制稀硫酸时将水倒入浓硫酸中并不断搅拌 |
| D、不慎洒出的酒精在桌上着火时,立即用大量水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com