
| A、反应2H2O═2H2+O2在任何条件下都不会自发进行 | ||
B、溶液CH3COOH加水稀释后,溶液中
| ||
| C、温度升高,反应物的活化分子数增多,主要因素是分子的运动加快,反应速率加快 | ||
| D、Na2CO3液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
| c(CH3COOH) |
| c(CH3COO-) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Al3+、Fe3+ |
| B、SiO32-、[Al(OH)4]-、K+ |
| C、Ag+、Cu2+、Na+ |
| D、Ag+、Ba2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
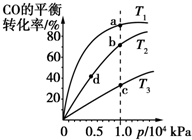 用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A、正反应速率:v(a)>v(c) v(b)>v(d) | ||||||||
| B、平衡时a点一定有n(CO):n(H2)=1:2 | ||||||||
| C、平衡常数:K(a)>K(c) K(b)=K(d) | ||||||||
D、平均摩尔质量:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:5 | B、1:2 |
| C、2:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Na+) |
| c(S2-) |
| A、H2S气体 |
| B、NaOH固体 |
| C、HCl气体 |
| D、KOH固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com