
【题目】在![]() 和
和![]() 的混合溶液中逐滴加入NaOH溶液直至过量,经测定,加入的NaOH的物质的量与所得沉淀的物质的量的关系如图所示:
的混合溶液中逐滴加入NaOH溶液直至过量,经测定,加入的NaOH的物质的量与所得沉淀的物质的量的关系如图所示:

(1)写出代表各线段发生反应的离子方程式:OD_________________,DC段_________________。
(2)原溶液中![]() 、
、![]() 物质的量浓度之比为______。
物质的量浓度之比为______。
(3)图中C点表示当加入_______molNaOH时,Al3+已经转化为___________,![]() 已经转化为____________。
已经转化为____________。
【答案】Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O 2:1 0.8mol NaAlO2 Mg(OH)2
【解析】
(1)MgCl2和AlCl3的混合溶液中,开始加入氢氧化钠,生成的是氢氧化镁和氢氧化铝沉淀,沉淀达到最高点时,镁离子、铝离子完全沉淀;继续加入氢氧化钠,会与氢氧化铝反应,沉淀溶解;
(2)根据从D到C,沉淀减少量为0.1mol,知道n[Al(OH)3]=n(AlCl3),n[Mg(OH)2]= n(MgCl2)进而求n(Mg2+):n(Al3+);
(3)根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓ 、Al(OH)3+OH-=AlO2-+2H2O计算。
(1)MgCl2和AlCl3的混合溶液中,开始加入氢氧化钠,生成的是氢氧化镁和氢氧化铝沉淀,沉淀达到最高点时,镁离子、铝离子完全沉淀,此时沉淀为0.3mol,OD段反应如下:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;继续加入氢氧化钠,会与氢氧化铝反应,沉淀溶解,DC反应如下:Al(OH)3+OH-=AlO2-+2H2O;
(2)根据从D到C,沉淀减少量为0.1mol,知道n[Al(OH)3]=n(AlCl3)=0.1mol,n[Mg(OH)2]= n(MgCl2)=0.3-n[Al(OH)3]=0.2mol;则n(Mg2+):n(Al3+)=2:1;
(3)根据方程式计算:
Mg2++2OH-=Mg(OH)2↓
0.2mol 0.4mol
Al3++3OH-=Al(OH)3↓
0.1mol 0.3mol
Al(OH)3+OH-=AlO2-+2H2O
0.1mol 0.1mol
加入的n(NaOH)=0.4+0.3+0.1=0.8mol时,Al3+已经转化为NaAlO2,Mg2+已经转化为沉淀Mg(OH)2。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是

A. 装置①可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室不可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)等质量的![]() 和
和![]() ,物质的量之比为______,在相同条件下的体积之比为_______,原子数之比为________.
,物质的量之比为______,在相同条件下的体积之比为_______,原子数之比为________.
(2)同温同压下,相同体积的![]() 和
和![]() 的质量比为_________。
的质量比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素(用字母x等表示)化合价与原子序数的关系图。

根据判断出的元素回答问题:
(1)h在周期表中的位置是__________。
(2)比较z、f、g、r常见离子的半径大小(用化学式表示,下同):______>______>______>______;比较r、m的最高价氧化物对应水化物的酸性强弱:______>______>;比较d、m的氢化物的沸点:______>______。
(3)x与氢元素能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)______,实验室制取该物质的化学方程式为:____________________________________。
(4)由y、m和氢元素组成一种离子化合物,写出其电子式:___________________________。
(5)用铅蓄电池作电源,惰性电极电解饱和em溶液,则电解反应的生成物为(写化学式)___________________________。铅蓄电池放电时正极反应式为式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A |
| 过量HC1 |
|
B |
| 过量 |
|
C |
| 过量 |
|
D | I-、Cl-、H+、SO42- | 过量 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
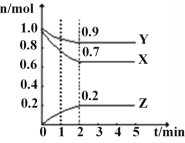
(1)从开始至2min,X的平均反应速率为__。
(2)该反应的化学方程式为___。
(3)1min时,v(正)__v(逆),2min时,v(正)__v(逆)。(填“>”或“<”或“=”)。
(4)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(X)=9mol·L-1·min-1,乙中v(Y)=0.5mol·L-1·s-1,则___中反应更快。
(5)若X、Y、Z均为气体,在2min时,向容器中通入氩气(容器体积不变),X的化学反应速率将___,若加入适合的催化剂,Y的化学反应速率将___。(填“变大”或“不变”或“变小”)。
(6)若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是___。
a.X、Y、Z三种气体的浓度相等
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=3︰1
e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3︰2
f.混合气体的密度不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物在生产和生活中有广泛的应用。
(1)钠长时间放在空气中,最后产物的主要成分是_____________(填化学式),保存金属钠的方法是___________________。
(2)某实验小组利用下图装置探究Na2O2与CO2的反应,请回答下列问题:

①根据实验目的,B处所盛放的试剂为__________,其作用为______________。
②装置C中观察到的现象是_________,反应的化学方程式是___________。
③装置D的作用是吸收未反应的CO2便于O2的检验,吸收CO2的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2![]() N2O4(正反应为放热反应) B. C(s)+CO2
N2O4(正反应为放热反应) B. C(s)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
C. N2+3H2![]() 2NH3(正反应为放热反应) D. H2S
2NH3(正反应为放热反应) D. H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com