
【题目】回答下列问题:
(1)等质量的![]() 和
和![]() ,物质的量之比为______,在相同条件下的体积之比为_______,原子数之比为________.
,物质的量之比为______,在相同条件下的体积之比为_______,原子数之比为________.
(2)同温同压下,相同体积的![]() 和
和![]() 的质量比为_________。
的质量比为_________。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol·L-1的NaOH溶液分别滴定HA和HB两种酸溶液,两种酸溶液的体积均为20.00 mL,浓度均为0.100 mol·L-1,滴定曲线如图所示。下列叙述正确的是( )

A. HA可以是醋酸,HB可以是HCl
B. 浓度相等时,B-的水解程度大于HB的电离程度
C. V(NaOH)=20.00 mL时,c(Na+)=c(A-)>c(B-)
D. pH=7时,滴定HB溶液消耗的V(NaOH)>20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是

A. 电源B极是正极
B. 装置(丁)中X极附近红褐色变深,说明氢氧化铁胶粒带正电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验方案合理的是( )
实验目的 | 实验设计 | |
A | 鉴别乙醇和二甲醚 | 分别取少量样品用元素分析仪进行测定 |
B | 用高锰酸钾溶液滴定未知浓度的乙二酸溶液 | 用待装液体分别润洗酸式和碱式滴定管再进行操作 |
C | 确定某无色溶液中含有 | 取少量待测液加 |
D | 鉴别 | 分别滴加氨水至过量,观察现象 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利酸性KMnO4溶液测定空气中甲醛的含量, (部分装置如图),其反应原理及步骤如下:
4MnO4-+5HCHO+H +=Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O

步骤:①量取5.00mL 1.00×10-3mol·L-1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10-3mol·L-1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气。再将注射器气体推入洗气瓶中充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL)。3次实验消耗草酸溶液的体积平均值为12.38mL。
回答下列问题
(1)此实验用指示剂____________(填字母)。A 甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(2)量取5.00mL KMnO4溶液应用______________滴定管
(3)下列操作能引起室内甲醛浓度偏高的是________。
a.滴定终点俯视读数 b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水 d.装草酸的滴定管未润洗
(4)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,如果向10 mL 0.01 molL-1 H2C2O4溶液中滴加0.0 1 molL-1 NaOH溶液
①当加入的NaOH溶液体积为10 mL,请你写出溶液中质子守恒关系式__________。
②当加入的NaOH溶液体积为20 mL,请你写出溶液中离子的浓度大小关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按如图所示装置进行实验,并回答下列问题:

(1)甲池,通入CH3OH(甲醇)的电极反应式为______________________。
(2)乙池中的总反应化学方程式为______________________。
(3)当甲池中消耗O20.56L(标准状况下)时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“c”或“d”)电极折出1.20g金属,则按丙装置中的的某盐溶液可能是__________________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
Ⅱ.SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控利和治理是优化我们生存环境的有效途径。

(4)利用化学原理将C0、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO一极为____________________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为____________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 和
和![]() 的混合溶液中逐滴加入NaOH溶液直至过量,经测定,加入的NaOH的物质的量与所得沉淀的物质的量的关系如图所示:
的混合溶液中逐滴加入NaOH溶液直至过量,经测定,加入的NaOH的物质的量与所得沉淀的物质的量的关系如图所示:

(1)写出代表各线段发生反应的离子方程式:OD_________________,DC段_________________。
(2)原溶液中![]() 、
、![]() 物质的量浓度之比为______。
物质的量浓度之比为______。
(3)图中C点表示当加入_______molNaOH时,Al3+已经转化为___________,![]() 已经转化为____________。
已经转化为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
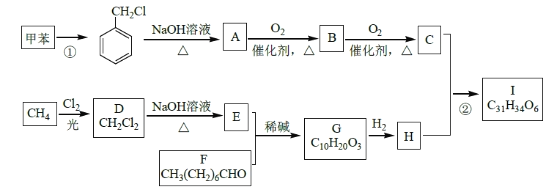

回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_____________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。
①遇FeCl3 溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
(5)设计用甲苯和乙醛为原料制备![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:![]() )____________。
)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是______________,水通入A的进口为________。(a/b)
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________(酚酞/甲基橙);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。

(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com